题目内容
10.设NA为阿伏加德罗常数的值,下列叙述中正确的是( )| A. | 常温常压下,3.2 g O3所含电子数为1.2 NA | |
| B. | 标准状况下,2.24 L CCl4中含有的C-Cl键的数目为0.4 NA | |
| C. | CO与N2互为等电子体,标准状况下11.2 L CO与0.5 molN2所含电子数相等 | |
| D. | 将0.1 mol 氯化铁溶于1 L水中,所得溶液含有0.1 NA Fe3+ |
分析 A、求出臭氧的物质的量,然后根据臭氧中含24个电子;
B、标况下四氯化碳为液态;
C、求出CO的物质的量,然后根据CO和氮气为等电子体来分析;
D、铁离子为弱碱阳离子,在溶液中会水解.
解答 解:A、3.2g臭氧的物质的量为n=$\frac{3.2g}{48g/mol}$=$\frac{2}{30}$mol,而臭氧中含24个电子,故$\frac{2}{30}$mol臭氧中含1.6mol电子即1.6NA个电子,故A错误;
B、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量,故B错误;
C、标况下11.2LCO的物质的量为0.5mol,而CO和氮气为等电子体,故等物质的量的CO和氮气含有的电子数相同,故C正确;
D、铁离子为弱碱阳离子,在溶液中会水解,故溶液中的铁离子的个数小于0.1NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
9.对下列实验的现象和结论的分析正确的是( )
| A. | 某溶液$\stackrel{+石蕊}{→}$溶液呈红色:原溶液是酸溶液 | |
| B. | 某溶液$\stackrel{+盐酸酸化}{→}$无明显现象$\stackrel{+BaCl_{2}溶液}{→}$有白色沉淀:原溶液中含SO42- | |
| C. | 某溶液$\stackrel{+酚酞}{→}$溶液呈红色:原溶液是碱溶液 | |
| D. | 某溶液$\stackrel{+稀硫酸}{→}$生成无色无味气体,说明原溶液中有CO32- |
18.下列溶液中,微粒浓度关系正确的是( )
| A. | 含有NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)<c(OH-) | |
| B. | pH=6的醋酸与醋酸钠的混合溶液中,c(Na+)>c(CH3COO-) | |
| C. | 0.1 mol/L 的Na2S溶液中,c(OH)=c(H+)+c(HS-)+2c(H2S) | |
| D. | pH=3的一元酸和pH=11的一元碱等体积混和后的溶液中,一定是c(OH-)=c(H+) |
15.用NA表示阿伏加德罗常数,下列说法错误的是( )
| A. | 25℃时1mL水中含10-10 NA个OH-离子 | |
| B. | 1molCl2通入足量的NaOH溶液中充分反应转移的电子数为2NA | |
| C. | a g某气体含分子数为b,c g该气体在标况下的体积约为22.4bc/(aNA)L | |
| D. | 0.1mol钠和O2在一定条件下反应生成Na2O和Na2O2混合物时,失去电子数为0.1NA |
2.某化学实验小组同学向用大理石和稀盐酸制备CO2后的残留液中滴加碳酸钠溶液,在溶液中插入pH传感器,测得pH变化曲线如图所示.下列有关说法不正确的是( )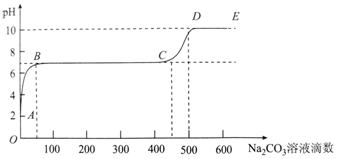

| A. | 开始时溶液pH=2是因为残留液中还有盐酸剩余 | |
| B. | BC段表示随着碳酸钠溶液的滴入,CaCO3沉淀的质量逐渐增加 | |
| C. | AB发生的反应为:Ca2++CO32-═CaCO3↓ | |
| D. | 滴入500滴碳酸钠溶液后溶液中c(OH-)>c(H+) |
19.-种制取粗碘的工艺流程如图所示,下列有关说法错误的是( )

| A. | 步骤②中的萃取过程为物理变化 | |
| B. | 步骤③发生的反应中I2是氧化剂,NaOH是还原剂 | |
| C. | 步骤④所加的试剂X可能是稀硫酸 | |
| D. | 步骤⑤涉及的主要操作Y为分液和蒸馏 |

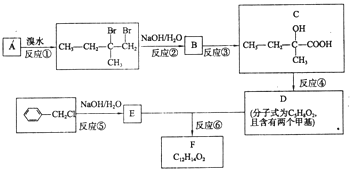 分子式为C12H14O2的有机物F广泛用于制备香精的调香剂.为了合成该有机物,某实验室的科技人员设计了下列合成路线.
分子式为C12H14O2的有机物F广泛用于制备香精的调香剂.为了合成该有机物,某实验室的科技人员设计了下列合成路线. .
.