题目内容
15.在元素周期表中,一稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,B、D两元素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高.(1)B元素在周期表中的位置第四周期ⅡB族;D元素基态原子电子排布式为1s22s22p63s23p63d104s24p5.
(2)E的气态氢化物在同族元素中沸点最高的原因是:HF分子间存在氢键.
(3)A、C两元素第一电离能Ca>K.(填元素符号)
(4)B元素能形成多种配合物.元素之间形成配合物的条件是:一方是能够提供孤对电子的原子,另一方是提供空轨道的原子.
(5)A元素可与氢元素形成离子化合物,电子式为
 ;这种离子化合物可与水反应,化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑.
;这种离子化合物可与水反应,化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑.
分析 在元素周期表中,某稀有气体元素原子的最外层电子构型为4s24p6,处于第四周期,与其同周期的 A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,则A为Ca、C为K,B、D两元素原子的次外层电子数为18,则B为Zn、D为Br,E、D两元素处于同族,且在该族元素中E的气态氢化物的沸点最高,则E为F,据此解答.
解答 解:在元素周期表中,某稀有气体元素原子的最外层电子构型为4s24p6,处于第四周期,与其同周期的 A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,则A为Ca、C为K,B、D两元素原子的次外层电子数为18,则B为Zn、D为Br,E、D两元素处于同族,且在该族元素中E的气态氢化物的沸点最高,则E为F.
(1)B为Zn元素,核外电子排布式为:1s22s22p63s23p63d104s2,处于周期表中第四周期ⅡB族,D为Br元素,核外35个电子,基态原子电子排布式为:1s22s22p63s23p63d104s24p5;
故答案为:第四周期ⅡB族;1s22s22p63s23p63d104s24p5;
(2)HF分子间存在氢键,破坏它需要较高的能量,所以沸点较高,
故答案为:HF分子间存在氢键;
(3)Ca元素原子4s能级容纳2个电子,为全满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能Ca>K;
故答案为:Ca;K;
(4)含有孤电子对的原子与含有空轨道的原子能形成配位键;
故答案为:提供空轨道;
无论是Ca和K的单质还是它们的氢化物的固体,均能与水剧烈反应生成气体,发生反应为:Ca+2H2O=Ca(OH)2+H2↑、2K+2H2O=KOH+H2↑、CaH2+2H2O=Ca(5)氢化钙为离子化合物,钙失去2个电子给H原子,从而形成了H负离子,其电子式为: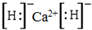 ;氢化钙与水反应生成氢氧化钙和氢气,其反应方程式为:CaH2+2H2O=Ca(OH)2+2H2↑;
;氢化钙与水反应生成氢氧化钙和氢气,其反应方程式为:CaH2+2H2O=Ca(OH)2+2H2↑;
故答案为: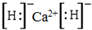 ;CaH2+2H2O=Ca(OH)2+2H2↑.
;CaH2+2H2O=Ca(OH)2+2H2↑.
点评 本题考查位置结构性质关系应用,题目难度中等,涉及核外电子排布、氢键、电离能、化学方程式等知识点,关键掌握核外电子排布规律,注意理解同周期元素第一电离能异常情况.

| A. | 所得气体在标准状况下的体积 | B. | 所得气体的质量 | ||
| C. | 所得溶液的浓度 | D. | 原硫酸的浓度 |
| A. | 用加热法测定胆矾晶体中结晶水含量时,若在空气中冷却会使结果偏低 | |
| B. | 配制氯化铁溶液时,先将氯化铁溶于较浓盐酸,再用蒸馏水稀释并加入少量铁粉 | |
| C. | 将甲烷和乙烯的混合气体通过盛有浓溴水的洗气瓶,即可提纯甲烷 | |
| D. | 将蔗糖和稀硫酸混合加热后,再加入银氨溶液并水浴加热,以检验还原性糖 |
| A. | 2Na2O2+2 Mn2O7=4Na2MnO4+O2 | B. | Na2O2+2NO2=2NaNO2+O2 | ||
| C. | 2Na2O2+2N2O3=4NaNO2+O2 | D. | 2Na2O2+2N2O4=4NaNO3 |
| A. | N2、O2和Cl2分子中既含有σ键,又含有π键 | |
| B. | PCl3分子中,中心原子采取SP3杂化方式 | |
| C. | CS2、H2O、C2H2都是直线型分子 | |
| D. | CH4、CCl4、C6H6都是只含有极性键的非极性分子 |
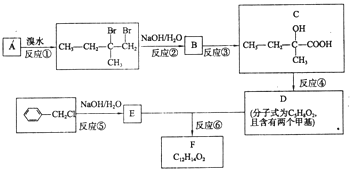 分子式为C12H14O2的有机物F广泛用于制备香精的调香剂.为了合成该有机物,某实验室的科技人员设计了下列合成路线.
分子式为C12H14O2的有机物F广泛用于制备香精的调香剂.为了合成该有机物,某实验室的科技人员设计了下列合成路线. .
.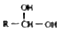 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$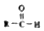 请根据如图回答:
请根据如图回答:
 .
. ;②CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O+3H2O.
;②CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O+3H2O.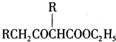 +C2H3OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).
+C2H3OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).