题目内容
【题目】三氧化二镍(Ni2O3)是一种重要的化学材料。工业上利用含镍废料(镍、铁、 钙、镁合盒为主)制取草酸镍(NiC2O4).再高温煅烧草酸镍制取三氧化二镍。(已知草酸的钙、镁、镍盐均难溶干水。)工艺流程如图所示:
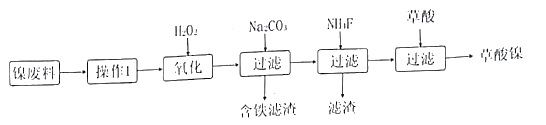
请回答下列问题:
(1)操作I为____。加入H2O2发生的主要反应的离子方程式为_____;加入碳酸钠溶液调节pH至4.0一5.0,其目的为______。
(2)若加入NH4F时滤液中c(Mg2+)=0.02 mol/L,设溶液体积不变,使滤液中Ca2+恰好沉淀完全,即溶液中c(Ca2+ )=1×10-5mol/L,判断此时是否有MgF2沉淀生成并加以解释:___。(已知CaF2、MgF2的Ksp分别为2.5×10-12、7.4×10-11)
(3)草酸镍高温煅烧,可制得Ni2O3,同时获得混合气体,该混合气体的主要成分为____。
(4)工业上还可用电解法制取N12O3,用NaOH溶液调节NiCl2溶液的pH至7.5,加入适量Na2SO4后用惰性电极电解。电解过程中产生的Cl2在弱碱性条件下生成ClO -,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为____。以Al和Ni2O3为电极,NaOH溶液为电解质溶液组成一种新型电池,放电时,Ni2O3转化为Ni(OH)2,该电池反应的化学方程式是____。
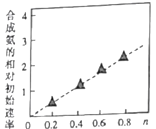
(5) Ni2O3还可用于制备合成氨的催化剂ConNi(1-n)Fe2O4。在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线如图,由图可知Co2+、Ni2+两种离子中催化效果更好的是____。
【答案】 加酸溶解,过滤 2Fe2++H2O2+2H+=2Fe3++2H2O 调节pH,促进铁离子水解,沉淀完全 有沉淀生成;Ksp(CaF2)=c(Ca2+)c2(F-)=1×10-5mol/L![]() c2(F-)=2.5×10-12, c2(F-)=2.5×10-7;c(Mg2+)=0.02 mol/L,Q(MgF2)=c(Mg2+)c2(F-)=0.02 mol/L×2.5×10-7=5.0×10-9>7.4×10-11=Ksp(MgF2) CO、CO2 ClO-+2Ni(OH)2=Cl-+Ni2O3+2H2O Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2 Co2+
c2(F-)=2.5×10-12, c2(F-)=2.5×10-7;c(Mg2+)=0.02 mol/L,Q(MgF2)=c(Mg2+)c2(F-)=0.02 mol/L×2.5×10-7=5.0×10-9>7.4×10-11=Ksp(MgF2) CO、CO2 ClO-+2Ni(OH)2=Cl-+Ni2O3+2H2O Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2 Co2+
【解析】(1)分析工艺流程图可知,含镍废料(镍、铁、钙、镁合金为主),要使之变成离子,应该加酸溶解金属,再除去不溶物,所以操作Ⅰ为加酸溶解,过滤;加双氧水的目的是氧化Fe2+生成Fe3+,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;加入碳酸钠溶液的作用是调节pH,促进铁离子水解,沉淀完全; (2)Ksp(CaF2)=c(Ca2+ )c2(F-)=1×10-5mol/L![]() c2(F-)=2.5×10-12, c2(F-)=2.5×10-7;c(Mg2+)=0.02 mol/L,Q(MgF2)=c(Mg2+ )c2(F-)=0.02 mol/L×2.5×10-7=5.0×10-9>7.4×10-11= Ksp(MgF2),故有沉淀生成;(3)草酸镍(NiC2O42H2O)在热空气中干燥脱水后生成NiC2O4,NiC2O4再发生氧化还原反应,Ni由+2价升高到+3价,则C由+3价降低到+2价,因为生成了混合气体,则另一气体为CO2,所以反应生成Ni2O3、CO、CO2,故该混合气体的主要成分为CO、CO2;(4)ClO-具有氧化性,Cl由+1价降低到-1价,Ni由+2价升高到+3价,利用化合价升降相等可配平ClO-、Ni(OH)2、Cl-、Ni2O3的系数,再利用H原子守恒配平水的系数,得到的离子方程式为ClO-+2Ni(OH)2=Cl-+Ni2O3+2H2O;以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时,NiO(OH)转化为Ni(OH)2,Ni的化合价由+3价降低到+2价,则正极反应为3NiO(OH)+3e-+3H2O=3Ni(OH)2+3OH-,负极是Al失电子生成NaAlO2,负极电极反应为Al-3e-+4OH-=AlO2-+2H2O,正、负极相加得电池的总反应,则该电池反应的化学方程式是Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2;(5)由图可知,随n值越大,合成氨的相对初始速率越大,而n增大,Co2+的比例增大,故Co2+的催化活性更高。
c2(F-)=2.5×10-12, c2(F-)=2.5×10-7;c(Mg2+)=0.02 mol/L,Q(MgF2)=c(Mg2+ )c2(F-)=0.02 mol/L×2.5×10-7=5.0×10-9>7.4×10-11= Ksp(MgF2),故有沉淀生成;(3)草酸镍(NiC2O42H2O)在热空气中干燥脱水后生成NiC2O4,NiC2O4再发生氧化还原反应,Ni由+2价升高到+3价,则C由+3价降低到+2价,因为生成了混合气体,则另一气体为CO2,所以反应生成Ni2O3、CO、CO2,故该混合气体的主要成分为CO、CO2;(4)ClO-具有氧化性,Cl由+1价降低到-1价,Ni由+2价升高到+3价,利用化合价升降相等可配平ClO-、Ni(OH)2、Cl-、Ni2O3的系数,再利用H原子守恒配平水的系数,得到的离子方程式为ClO-+2Ni(OH)2=Cl-+Ni2O3+2H2O;以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时,NiO(OH)转化为Ni(OH)2,Ni的化合价由+3价降低到+2价,则正极反应为3NiO(OH)+3e-+3H2O=3Ni(OH)2+3OH-,负极是Al失电子生成NaAlO2,负极电极反应为Al-3e-+4OH-=AlO2-+2H2O,正、负极相加得电池的总反应,则该电池反应的化学方程式是Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2;(5)由图可知,随n值越大,合成氨的相对初始速率越大,而n增大,Co2+的比例增大,故Co2+的催化活性更高。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表所示。
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表所示。
t ℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_______________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)某温度下,各物质平衡浓度符合:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为______。
(4)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡____________移动(填“向正反应方向”“向逆反应方向”或“不”)。
(5)若1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为____(填“正反应方向”“逆反应方向”或“不移动”)。