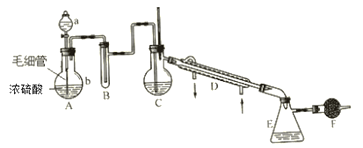
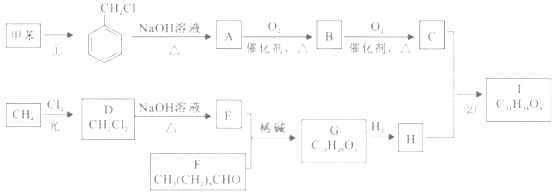
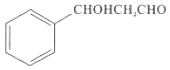
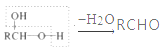题目内容
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,回答问题:
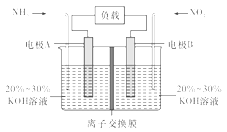

(1)电流从____(选填“左”或“右”,下同)侧电极经过负载后流向______侧电极。
(2)为使电池持续放电,离子交换膜需选用______离子交换膜(选填“阴”或“阳”)。
(3)A电极上的电极反应式为___________________________。
(4)当有4.48 L NO2(标准状况)被处理时,转移电子为________摩尔。
(5)负载可以测定电流大小,从而确定气体含量,酒驾测定工作原理与其相似。仔细阅读图:写出阴极反应式:____________________________。
【答案】右 左 阴 2NH3-6e-+6OH-=N2+6H2O 0.8 O2+4e-+4H+=2H2O
【解析】
由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极。
(1)A侧电极失去电子,电子流向为A电极→负载→B电极,故电流流向与电子流向相反为B电极→负载→A电极,故答案为:右;左。
(2)原电池工作时,阴离子向负极移动,为使电池持续放电,离子交换膜需选用阴离子交换膜,防止二氧化氮反应生成硝酸盐和亚硝酸盐,导致原电池不能正常工作,故答案为:阴。
(3)电解质溶液呈碱性,则负极电极方程式为2NH3-6e-+6OH-=N2+6H2O。
(4)当有4.48L NO2(标准状况)即0.2mol被处理时,转移电子为0.2mol×(4-0)=0.8mol。
(5)负载与电池相连,则负载为电解池,电池总反应为CH3CH2OH+O2→CH3COOH+H2O,阴极反应式为O2+4e-+4H+=2H2O。

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | I3—溶液中存在平衡: I3— |
B | 在Ca(ClO)2溶液中通入SO2气体,有沉淀生成 | 酸性:H2SO3>HClO |
C | 向淀粉碘化钾溶液中通入过量氯气,溶液由无色变为蓝色,后蓝色褪去 | 氯气具有强氧化性和漂白性 |
D | 在植物油中滴几滴酸性高锰酸钾溶液,振荡,溶液褪色 | 植物油含有酯基 |
A.AB.BC.CD.D