题目内容
【题目】化合物AX3和单质X在一定条件下反应可生成化合物AX3。反应AX3(g)+X2(g)=AX5(g)在容积为10L的密闭容器中进行。起始时AX3和X2均为0.2mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示。回答下列问题:
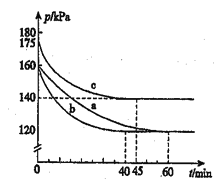
(1)下列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)=_________
(2)图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为____(填实验序号);与实验a相比,b改变的实验条件及判断依据是:_________
(3)用p0表示开始时总压强,p表示平衡时总压强,α表示AX5的平衡转化率,则a的表达式为_______;实验a和c的平衡转化率:αa为______,αc为_______。
【答案】 0.10mol/(10L×60min)=1.7×10-4mol·L-1·min-1 bca b:加入催化剂。反应速率加快,但平衡点没有改变 a=2(1-p/p0) 50% 40%
【解析】(1)依据体积不变的密闭容器中压强之比就等于物质的量之比有,实验a开始时n0=0.4mol,总压强为160kPa,则可列比例式:![]() =
=![]() ,n=0.4mol×
,n=0.4mol×![]() =0.3mol。假设平衡时AX5的物质的量为x,可列式如下:
=0.3mol。假设平衡时AX5的物质的量为x,可列式如下:
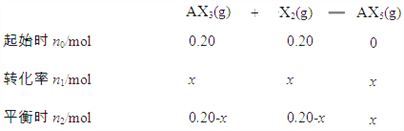
(0.20-x)+(0.20-x)+x=0.3 解得:x=0.1,
v(AX5)=![]() =1.7×10-4mol·L-1·min-1;
=1.7×10-4mol·L-1·min-1;
(2)由图像知,达到平衡所需时间:a>c>b,所以反应速率.v(AX5)由大到小的顺序为b>c>a;与实验a相比,实验b先达到平衡,化学反应速率快,但平衡没有变化,说明实验b加入了催化剂;
(3) 用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,
AX3(g)+ X2(g)![]() AX5(g)
AX5(g)
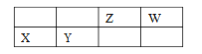
初始 (mol) 0.20 0.20 0
平衡 (mol) 0.20-x 0.20-x x
(0.20-x)+(0.20-x)+x=n,则x= 0.40-n
αa=50%; αc==40%。