题目内容
【题目】苯乙烯是重要的基础有机化工原料。工业中以乙苯(C6H5—CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5—CH=CH2),反应的化学方程式为C6H5—CH2CH3(g)![]() C6H5—CH=CH2(g)+H2(g) ΔH=a kJ·mol-1。
C6H5—CH=CH2(g)+H2(g) ΔH=a kJ·mol-1。
(1)乙苯在特定催化剂下发生氧化脱氢:C6H5—CH2CH3(g)+1/2O2(g)![]() C6H5—CH=CH2(g)+H2O(g) ΔH1
C6H5—CH=CH2(g)+H2O(g) ΔH1
已知H2的燃烧热ΔH=b kJ·mol-1,水的汽化热为c J·g-1,则ΔH1=________。
(2)①在汽车上安装三元催化转化器可实现反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0。则该反应在________(填“高温”“低温”或“任何温度”)下能自发进行。
N2(g)+2CO2(g) ΔH<0。则该反应在________(填“高温”“低温”或“任何温度”)下能自发进行。
②在某温度下,2 L密闭容器中充入NO、CO各0.4 mol进行反应,测得NO物质的量变化如图所示,5 min末反应达到平衡。第6 min继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,请在图中画出到9 min末反应达到平衡NO的物质的量随时间的变化曲线_______________。

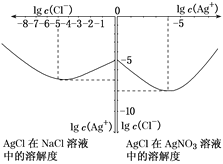
(3)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl+Cl-=[AgCl2]-,下图是某温度下AgCl在NaCl溶液中的溶解情况。
①由图知,该温度下AgCl的溶度积常数为________。
②AgCl在NaCl溶液中的溶解度出现如图所示情况(先变小后变大)的原因是:______________________。
【答案】(a+b+0.018c)kJ·mol-1 低温 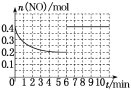 10-12 开始Cl-抑制了AgCl的溶解,AgCl的溶解度变小,但c(Cl-)增大使AgCl形成[AgCl2]-络合物,所以AgCl的溶解度又变大
10-12 开始Cl-抑制了AgCl的溶解,AgCl的溶解度变小,但c(Cl-)增大使AgCl形成[AgCl2]-络合物,所以AgCl的溶解度又变大
【解析】
(1)由H2的燃烧热ΔH=b kJ·mol-1,得:①H2(g)+1/2O2(g)=H2O(l) ΔH=b kJ·mol-1,由水的汽化热为c J·g-1,即0.018c kJ·mol-1,得:②H2O(l)=H2O(g) ΔH=0.018c kJ·mol-1,又知③C6H5-CH2CH3(g)![]() C6H5—CH=CH2(g)+H2(g) ΔH1=a kJ·mol-1;根据盖斯定律,由③+①+②得:C6H5—CH2CH3(g)+1/2O2(g)
C6H5—CH=CH2(g)+H2(g) ΔH1=a kJ·mol-1;根据盖斯定律,由③+①+②得:C6H5—CH2CH3(g)+1/2O2(g)![]() C6H5—CH=CH2(g)+H2O(g),即可求出ΔH。
C6H5—CH=CH2(g)+H2O(g),即可求出ΔH。
(2)①反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0的正反应是气体体积减小的反应,ΔS<0,低温下满足ΔH-TΔS<0,即在低温时反应自发进行;②由题意知反应为2NO(g)+2CO(g)
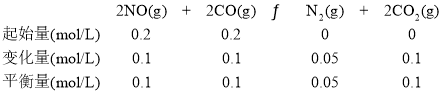
N2(g)+2CO2(g) ΔH<0的正反应是气体体积减小的反应,ΔS<0,低温下满足ΔH-TΔS<0,即在低温时反应自发进行;②由题意知反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g),2 L密闭容器中充入NO、CO各0.4 mol,达到平衡时NO为0.2 mol。
N2(g)+2CO2(g),2 L密闭容器中充入NO、CO各0.4 mol,达到平衡时NO为0.2 mol。
将数据代入公式K=![]() ,即可求出K。
,即可求出K。
第6 min继续加入0.2 mol NO,0.2 mol CO、0.2 mol CO2、0.3 mol N2,此时,c(NO)=c(CO)=c(CO2)=c(N2)=0.2 mol·L-1,将数据代入公式Q=![]() ,并将数值与K进行比较,即可说明平衡移动情况;第6 min继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,依据平衡移动情况,确定NO的物质的量变化,从而绘出坐标图象。
,并将数值与K进行比较,即可说明平衡移动情况;第6 min继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,依据平衡移动情况,确定NO的物质的量变化,从而绘出坐标图象。
(3)①由题图2可知,当c(Ag+)=10-5 mol·L-1时,c(Cl-)=10-7 mol·L-1,代入AgCl的溶度积常数公式Ksp=c(Ag+)·c(Cl-),即可求出结果;②根据沉淀溶解平衡:AgCl(s) ![]() Cl-(aq)+Ag+(aq),将AgCl放在NaCl溶液中,起初是同离子效应,后来是发生反应AgCl+Cl-=[AgCl2]-。
Cl-(aq)+Ag+(aq),将AgCl放在NaCl溶液中,起初是同离子效应,后来是发生反应AgCl+Cl-=[AgCl2]-。
(1)由H2的燃烧热ΔH=b kJ·mol-1,得:①H2(g)+1/2O2(g)=HO(l) ΔH=b kJ·mol-1,由水的汽化热为c J·g-1,即0.018c kJ·mol-1,得:②H2O(l)=H2O(g) ΔH=0.018c kJ·mol-1,又知③C6H5-CH2CH3(g)![]() C6H5—CH=CH2(g)+H2(g) ΔH1=a kJ·mol-1;根据盖斯定律,由③+①+②得:C6H5—CH2CH3(g)+1/2O2(g)
C6H5—CH=CH2(g)+H2(g) ΔH1=a kJ·mol-1;根据盖斯定律,由③+①+②得:C6H5—CH2CH3(g)+1/2O2(g)![]() C6H5—CH=CH2(g)+H2O(g),故ΔH=a kJ·mol-1+b kJ·mol-1+0.018c kJ·mol-1=(a+b+0.018c)kJ·mol-1。答案为:(a+b+0.018c)kJ·mol-1;
C6H5—CH=CH2(g)+H2O(g),故ΔH=a kJ·mol-1+b kJ·mol-1+0.018c kJ·mol-1=(a+b+0.018c)kJ·mol-1。答案为:(a+b+0.018c)kJ·mol-1;
(2)①反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0的正反应是气体体积减小的反应,ΔS<0,低温下满足ΔH-TΔS<0,即在低温时反应自发进行;答案为:低温;
N2(g)+2CO2(g) ΔH<0的正反应是气体体积减小的反应,ΔS<0,低温下满足ΔH-TΔS<0,即在低温时反应自发进行;答案为:低温;
②由题意知反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g),2 L密闭容器中充入NO、CO各0.4 mol,达到平衡时NO为0.2 mol。
N2(g)+2CO2(g),2 L密闭容器中充入NO、CO各0.4 mol,达到平衡时NO为0.2 mol。

K=![]() =5,第6 min继续加入0.2 mol NO,0.2 mol CO、0.2 mol CO2、0.3 mol N2,此时,c(NO)=c(CO)=c(CO2)=c(N2)=0.2 mol·L-1,Q=
=5,第6 min继续加入0.2 mol NO,0.2 mol CO、0.2 mol CO2、0.3 mol N2,此时,c(NO)=c(CO)=c(CO2)=c(N2)=0.2 mol·L-1,Q=![]() =5=K,说明是平衡状态,所以第6 min继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,仍是平衡状态,但是NO的物质的量变为原来的2倍。则9 min末反应达到平衡NO的物质的量随时间的变化曲线为
=5=K,说明是平衡状态,所以第6 min继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,仍是平衡状态,但是NO的物质的量变为原来的2倍。则9 min末反应达到平衡NO的物质的量随时间的变化曲线为 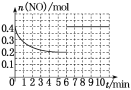 。答案为:
。答案为: ;
;
(3)①由题图2可知,当c(Ag+)=10-5 mol·L-1时,c(Cl-)=10-7 mol·L-1,AgCl的溶度积常数Ksp=c(Ag+)·c(Cl-)=10-5×10-7=10-12;答案为:10-12;
②根据沉淀溶解平衡:AgCl(s) ![]() Cl-(aq)+Ag+(aq),将AgCl放在NaCl溶液中,Cl-抑制了AgCl的溶解,但随c(Cl-)增大,发生反应AgCl+Cl-=[AgCl2]-,使AgCl的溶解度增大。答案为:开始Cl-抑制了AgCl的溶解,AgCl的溶解度变小,但c(Cl-)增大使AgCl形成[AgCl2]-络合物,所以AgCl的溶解度又变大。
Cl-(aq)+Ag+(aq),将AgCl放在NaCl溶液中,Cl-抑制了AgCl的溶解,但随c(Cl-)增大,发生反应AgCl+Cl-=[AgCl2]-,使AgCl的溶解度增大。答案为:开始Cl-抑制了AgCl的溶解,AgCl的溶解度变小,但c(Cl-)增大使AgCl形成[AgCl2]-络合物,所以AgCl的溶解度又变大。