题目内容
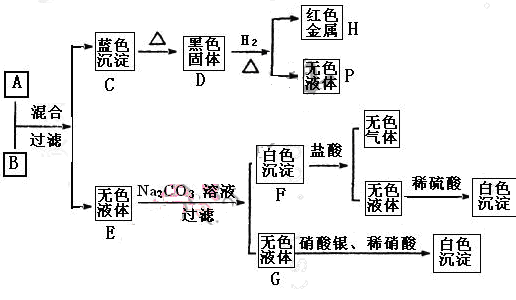
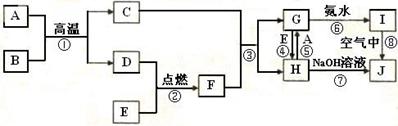
A-J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末, C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。回答下列问题:

(1)B中阴离子的电子式为 ,与E组成元素相同的化合物的结构式为 。
(2)已知D与G反应生成ImolE放出的热量为aKJ,请写出表示D与H2SO4中和热的热化学方程式 。
(3)向FeCl2溶液中加入大量固体B,写出反应离子方程式 。
(4)常温下以Pt为电极电解滴加有少量酚酞的H饱和溶液2L,则在 (填“阴或阳”)极附近溶液由无色变为红色,若用F、C组成电池(熔融K2CO3做电解质)供电,电池的负极反应式为 ,正极反应式为 ,电解过程中,忽略溶液体积变化,则当溶液的PH=13时,负极消耗气体的体积在标况下为 。

(1)B中阴离子的电子式为 ,与E组成元素相同的化合物的结构式为 。
(2)已知D与G反应生成ImolE放出的热量为aKJ,请写出表示D与H2SO4中和热的热化学方程式 。
(3)向FeCl2溶液中加入大量固体B,写出反应离子方程式 。
(4)常温下以Pt为电极电解滴加有少量酚酞的H饱和溶液2L,则在 (填“阴或阳”)极附近溶液由无色变为红色,若用F、C组成电池(熔融K2CO3做电解质)供电,电池的负极反应式为 ,正极反应式为 ,电解过程中,忽略溶液体积变化,则当溶液的PH=13时,负极消耗气体的体积在标况下为 。
(1)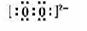 (2分);H—O—O—H(2分)
(2分);H—O—O—H(2分)
(2)NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(l)ΔH=-aKJ/mol(2分)
(3)4Fe2++4Na2O2+6H2O=4Fe(OH)3+O2↑+8Na+(2分)
(4)阴(1分);2H2-4e-+2CO32-=2H2O+2CO2(或H2-2e-+CO32-=H2O+CO2);(2分)O2+4e-+2CO2=2CO32-;(2分)2.24L(2分)
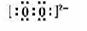 (2分);H—O—O—H(2分)
(2分);H—O—O—H(2分)(2)NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(l)ΔH=-aKJ/mol(2分)
(3)4Fe2++4Na2O2+6H2O=4Fe(OH)3+O2↑+8Na+(2分)
(4)阴(1分);2H2-4e-+2CO32-=2H2O+2CO2(或H2-2e-+CO32-=H2O+CO2);(2分)O2+4e-+2CO2=2CO32-;(2分)2.24L(2分)
试题分析:B为淡黄色粉末,推断B是Na2O2,E在常温下为液体,E是H2O,可知A是Na,C是O2,F是H2,D是NaOH,J可用作杀菌消毒剂,推断J是NaClO,可知H是NaCl,G是HCl,I是Cl2。
B中阴离子是O22-,电子式为
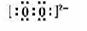 与E组成元素相同的是H2O2结构式为H—O—O—H;
与E组成元素相同的是H2O2结构式为H—O—O—H;(2)NaOH与HCl反应生成1mol水放出热量为aKJ/mol,NaOH与硫酸反应生成1mol水放出热量是相同的,因此热方程为NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(l)ΔH=-aKJ/mol;
向FeCl2溶液中加入大量Na2O2,Na2O2与水反应生成NaOH和O2,Fe2+被氧化为Fe(OH)3,离子方程式为4Fe2++4Na2O2+6H2O=4Fe(OH)3+O2↑+8Na+
电解NaCl溶液,阴极H+得电子放出氢气,使水的电离平衡向右移动,C(OH-)>C(H+),溶液显碱性;H2、O2和熔融K2CO3构成燃料电池,H2做负极发生氧化反应,O2做正极发生还原反应,2H2-4e-+2CO32-=2H2O+2CO2 O2+4e-+2CO2=2CO32-;当溶液的PH=13时,C(OH-)=0.1mol/L,每生成1molOH-转移1mole-,消耗1molH+,消耗0.5molH2,因此,n(H2)=0.5n(OH-)=0.1×2×0.5=0.1mol,体积为2.24L。

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目