��Ŀ����
����Ŀ��ij�¶�ʱ����һ���ݻ�Ϊ2L���ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ�� 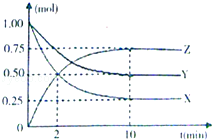
����ͼ�����ݣ�����������⣺
��1���÷�Ӧ�Ļ�ѧ������
��2����Ӧ��ʼ��2min������Z��ƽ����Ӧ����Ϊ��
��3����X��Y��Z��Ϊ���壬��Ӧ��ʼʱ��ƽ����ѹǿ֮���� ��
��4���ﵽƽ�������˵������ȷ����
A.X��Y��Z��Ũ��֮����1��2��3
B.X���������ʺ�Y�������������
C.Z��Ũ�ȱ��ֲ���
D.�����¶����´ﵽƽ�⣬Z��Ũ�ȼ�С����÷�ӦΪ���ȷ�Ӧ��
���𰸡�
��1��3X+2Y?3Z
��2��0.125mol/��L��min��
��3��4��3
��4��BD
����������1������ͼ֪�����ŷ�Ӧ�Ľ��У�X��Y�����ʵ������ٶ�Z�����ʵ�����������X��Y�Ƿ�Ӧ�Z�������10minʱ��Ӧ�ﵽƽ��״̬����μӷ�Ӧ�ġ�n��X��=��1.00��0.25��mol=0.75mol����n��Y��=��1.00��0.50��mol=0.50mol����n��Z��=��0.75��0��mol=0.75mol��ͬһ���淴Ӧ��ͬһʱ����ڲμӷ�Ӧ�ĸ����ʵ����ʵ���֮�ȵ����������֮�ȣ�����X��Y��Z�ļ�����֮��=0.75mol��0.50mol��0.75mol=3��2��3�����Ը÷�Ӧ����ʽΪ3X+2Y3Z�� ���Դ��ǣ�3X+2Y3Z����2��0��2min��Z��ƽ����Ӧ����= ![]() =
= ![]() =0.125mol/��L��min�������Դ��ǣ�0.125mol/��L��min������3�����º��������£������ѹǿ֮�ȵ��������ʵ���֮�ȣ���Ӧǰ����������ʵ���=1.00mol��2=2.00mol��ƽ�������������ʵ���=��0.25+0.50+0.75��mol=1.50mol�����Է�Ӧ��ʼʱ��ƽ����ѹǿ֮��=2.00mol��1.50mol=4��3�����Դ��ǣ�4��3����4��A����ͬ�����У�X��Y��Z��Ũ��֮�ȵ��������ʵ���֮��=0.25mol��0.50mol=0.75mol=1��2��3����A��ȷ��B���÷�Ӧ��X��Y�ļ�����֮��Ϊ3��2����X������������Y����������֮��Ϊ3��2ʱ�÷�Ӧ�ﵽƽ��״̬�����Ե�X���������ʺ�Y�������������ʱ�÷�Ӧû�дﵽƽ��״̬����B����
=0.125mol/��L��min�������Դ��ǣ�0.125mol/��L��min������3�����º��������£������ѹǿ֮�ȵ��������ʵ���֮�ȣ���Ӧǰ����������ʵ���=1.00mol��2=2.00mol��ƽ�������������ʵ���=��0.25+0.50+0.75��mol=1.50mol�����Է�Ӧ��ʼʱ��ƽ����ѹǿ֮��=2.00mol��1.50mol=4��3�����Դ��ǣ�4��3����4��A����ͬ�����У�X��Y��Z��Ũ��֮�ȵ��������ʵ���֮��=0.25mol��0.50mol=0.75mol=1��2��3����A��ȷ��B���÷�Ӧ��X��Y�ļ�����֮��Ϊ3��2����X������������Y����������֮��Ϊ3��2ʱ�÷�Ӧ�ﵽƽ��״̬�����Ե�X���������ʺ�Y�������������ʱ�÷�Ӧû�дﵽƽ��״̬����B����
C����Z��Ũ�ȱ��ֲ���ʱ�����淴Ӧ������ȣ����淴Ӧ�ﵽƽ��״̬����C��ȷ��
D�������¶����´ﵽƽ�⣬Z��Ũ�ȼ�С��ƽ�������ƶ��������¶�ƽ�������ȷ����ƶ�����������Ӧ�Ƿ��ȷ�Ӧ����D����
��ѡBD��

 ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д� ͬ����ϰ����ʦ����ѧ������ϵ�д�
ͬ����ϰ����ʦ����ѧ������ϵ�д�����Ŀ������ʵ���У�����ȡ�ķ��뷽�����Ӧԭ������ȷ���ǣ� ��
ѡ�� | Ŀ�� | ���뷽�� | ԭ�� |
A�� | ��������ˮ�еĵ� | �Ҵ���ȡ | �����Ҵ��е��ܽ�Ƚϴ� |
B�� | ���������������Ҵ� | ��Һ | �����������Ҵ����ܶȲ�ͬ |
C�� | ��ȥKNO3�����л��ӵ�NaCl | �ؽᾧ | NaCl��ˮ�е��ܽ�Ⱥܴ� |
D�� | ��ȥ�����е����� | ���� | ���������ѵķе����ϴ� |