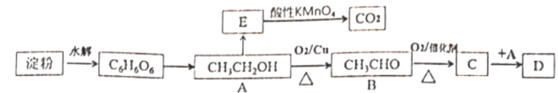
题目内容
【题目】下列说法正确的是 ( )
A.水的电离方程式:H2O = H++OH-B.pH=7的溶液一定是中性溶液
C.升高温度,水的电离程度增大D.将稀醋酸加水稀释时,溶液中所有离子浓度均减小
【答案】C
【解析】
A、水为弱电解质,其电离属于不完全电离,其电离方程式为:H2O![]() H++OH-,故A错误;
H++OH-,故A错误;
B、pH=7的溶液中c(H+)=1×10-7mol/L,c(OH-)=![]() =
=![]() mol/L,因KW与温度有关,故无法确定该溶液中c(H+)与c(OH-)相对大小,即该溶液可能呈中性、酸性、碱性,故B错误;
mol/L,因KW与温度有关,故无法确定该溶液中c(H+)与c(OH-)相对大小,即该溶液可能呈中性、酸性、碱性,故B错误;
C、水的电离属于吸热过程,升高温度,水的电离平衡正向移动,水的电离程度增大,故C正确;
D、将醋酸溶液加水稀释时,溶液中H+、CH3COO-浓度将减小,根据温度不变,KW= c(H+)×c(OH-)不变可知,c(OH-)将增大,故D错误。

【题目】砂质土壤分析中常用 Karl Fischer法是测定其中微量水含量,该方法是利用I2和SO2反应定量消耗水作为原理(假设土壤中其他成分不参加反应),据此回答下列问题:
(1)写出该反应的化学反应方程式:_______________________。
步骤I:反应样品中的水
下图是某同学在实验室模拟Karl Fischer法的实验装置图:

(2)装置连接的顺序为a→____________(填接口字母顺序);M仪器的名称为________________,其在实验过程中的作用是:____________;
(3)操作步骤为:①连接装置并检查装置气密性,②装入药品,____________________;③关闭弹簧夹,打开分液漏斗活塞;④反应结束后,关闭分液漏斗活塞,继续通入N2,⑤取下D装置,···
步骤④中继续通入N2的目的是________________________________
步骤 II:测定剩余的碘
向反应后的D装置加入蒸馏水,过滤,充分洗涤,并合并洗涤液和滤液,将其配成250.00mL溶液,取25.00mL用0.20mol·L-1 Na2S2O3标准液滴定剩余的I2单质,已知反应如下:2S2O32-+I2=S4O62-+2I-。
(4)Na2S2O3标准液应装在_____________(填“酸式”、“碱式”)滴定管中;上述操作中,合并洗涤液和滤液的目的是__________________________;
(5)滴定实验重复四次得到数据如下:
实验 | ① | ② | ③ | ④ |
消耗的标准液的体积/mL | 18.37 | 20.05 | 19.95 | 20.00 |
①若实验开始时,向D装置中加入10.00 g土壤样品和10.16克I2(已知I2过量),则样品土壤中水的含量为_________%。
②若Na2S2O3标准液已部分氧化变质,则水含量测定结果将____________(填“偏高”、“ 偏低”或“不变”)。