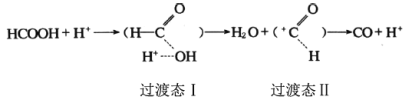
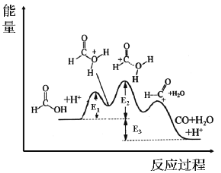
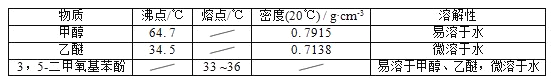
题目内容
【题目】将3. 84 g铜粉与一定质量浓硝酸反应,当铜完全作用时,溶液中的NO3-减少0.1mol,则所消耗硝酸的物质的量是
A.0.1 molB.0.11 molC.0.16 molD.0.22 mol
【答案】D
【解析】
方法①:Cu完全反应,与硝酸反应的HNO3分为2部分,一部分体现酸性,生成Cu(NO3)2,仍然在溶液中,另一部分体现出氧化性,生成NO2或者NO2和NO的混合气体;根据N守恒,体现出酸性的n(HNO3)=2n(Cu)= ![]() ,体现出氧化性的n(HNO3)等于溶液中减少的硝酸,为0.1mol,则总物质的量为0.12mol+0.1mol=0.22mol;
,体现出氧化性的n(HNO3)等于溶液中减少的硝酸,为0.1mol,则总物质的量为0.12mol+0.1mol=0.22mol;
方法②:假设xmol的Cu与浓硝酸作用,ymol的Cu与稀硝酸作用,则
x+y=0.06,![]() , 解得x=0.045,y=0.015,则消耗的酸的物质的量为4×0.045+
, 解得x=0.045,y=0.015,则消耗的酸的物质的量为4×0.045+![]() ×0.015=0.22;
×0.015=0.22;
故答案选D。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案【题目】用50mL0.50mol/L 盐酸与50 mL0.55mol/LNaOH溶液,在右图装置中进行中和热的测定,请回答下列问题:
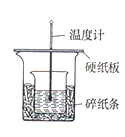
(1)从实验装置看,图中尚缺少的一种玻璃用品是________。
(2)在操作正确的前提下,提高中和热测定准确性的关键是________。
(3)做1次完整的中和热测定实验,温度计需使用________次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?________。
(4)某同学实验记录数据如下表所示假设盐酸和氢氧化钠溶液的密度都是1g/mL,又知中和反应后生成溶液的比热容c=4.18J/(g.℃)根据该同学的实验数据计算,该实验测的中和热△H=________。
温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | |||
HCl | NaOH | ||||
1 | 20.0 | 20.1 | 23.2 | ||
2 | 20.2 | 20.4 | 23.4 | ||
3 | 20.5 | 20.6 | 23.6 | ||