题目内容
下列离子方程式中,正确的是( )
| A.稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑ |
| B.氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O |
| C.铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
| D.稀盐酸滴在石灰石上:CaCO3+2H+═Ca2++H2CO3 |
A、稀硫酸滴在铁片上反应的离子方程式为:Fe+2H+=Fe2++H2↑,故A错误;
B、氧化镁与稀盐酸混合反应的离子方程式为:MgO+2H+=Mg2++H2O,故B正确;
C、铜片插入硝酸银溶液中反应的离子方程式为:Cu+2Ag+=Cu2++2Ag,故C错误;
D、稀盐酸滴在石灰石上反应的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故D错误;
故选B.
B、氧化镁与稀盐酸混合反应的离子方程式为:MgO+2H+=Mg2++H2O,故B正确;
C、铜片插入硝酸银溶液中反应的离子方程式为:Cu+2Ag+=Cu2++2Ag,故C错误;
D、稀盐酸滴在石灰石上反应的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故D错误;
故选B.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
铁及其化合物在生产、生活中有广泛应用。请回答下列问题:
(1)水热法制备Fe3O4纳米颗粒的反应是:3Fe2++2S2O32-+O2+xOH-→Fe3O4↓+S4O32-+2H2O
①上述离子方程式中x=________;
②每生成1 mol Fe3O4,反应转移的电子为________mol;
(2)某高效净水剂可由Fe(OH)SO4聚合得到。工业上以FeSO4、NaNO2和稀硫酸为原料来制备Fe(OH)SO4,反应中有NO生成,化学方程式为 。
高炉炼铁过程中发生的主要反应为: Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)

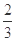 Fe(s)+CO2(g)+Q
Fe(s)+CO2(g)+Q
已知该反应在不同温度下的平衡常数如下:
|
温度/℃ |
1000 |
1115 |
1300 |
|
平衡常数 |
4.0 |
3.7 |
3.5 |
(3)该反应的平衡常数表达式K=_ ;Q 0(填“>”、“<”或“=”);
(4)欲提高上述反应中CO的平衡转化率,可采取的措施是 ;
A.提高反应温度 B.移出部分CO2
C.加入合适的催化剂 D.减小容器的容积
(5)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,此时v正 v逆(填“等于”、“大于”或“小于”)。经过l0 min,在1000℃达到平衡,则该时间范围内反应的平均反应速率v (CO2)= 。



 式 。
式 。