��Ŀ����
(8��)ʵ������ NaHSO4 ,Ba(OH)2, NH3 ? H2O NaHCO3��KAl(SO4)2������ɫ��Һ������ͨ������֮������Ӧ���������м��𡣲������ʼ�ķ�Ӧ�������±���
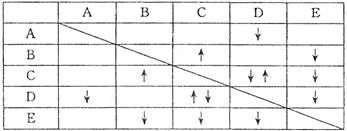
���С� ����ʾ�����������ʣ���
����ʾ�����������ʣ���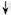 ����ʾ���ɳ�����
����ʾ���ɳ�����
����������Ϣ���ش��������⣺
(1)B��E�Ļ�ѧʽ�ֱ�Ϊ_______��___________��
(2) д��A�ĵ��뷽��ʽ___________________________����
(3) C��D����Һ��Ӧ�����ӷ���ʽΪ___________________________��
(4) ����0.1 mol���ʵ�D��Һ�еμ�E��Һ�������ɳ��������ʵ���֮�����Ϊ_________mol��

����
 ����ʾ�����������ʣ���
����ʾ�����������ʣ���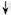 ����ʾ���ɳ�����
����ʾ���ɳ���������������Ϣ���ش��������⣺
(1)B��E�Ļ�ѧʽ�ֱ�Ϊ_______��___________��
(2) д��A�ĵ��뷽��ʽ___________________________����
(3) C��D����Һ��Ӧ�����ӷ���ʽΪ___________________________��
(4) ����0.1 mol���ʵ�D��Һ�еμ�E��Һ�������ɳ��������ʵ���֮�����Ϊ_________mol��
��8�֣���1��NaHSO4��Ba(OH)2 ��2�֣� ��2��NH3��H2O NH4++OH-��2�֣�
NH4++OH-��2�֣�
��3��Al3++3HCO3-= Al(OH)3��+3CO2����2�֣� ��4�� 0.25 ��2�֣�
 NH4++OH-��2�֣�
NH4++OH-��2�֣���3��Al3++3HCO3-= Al(OH)3��+3CO2����2�֣� ��4�� 0.25 ��2�֣�
���⿼�����ʼ�����ƶϡ�����Ĺؼ����ҵ�ͻ�Ƶ㡪���Ȳ��������ֲ������������������NaHCO3��KAl(SO4)2���ܷ���˫ˮ�ⷴӦ����Al(OH)3������CO2���壬���ͼ����Cֻ������һ�����ʲ�����������CΪNaHCO3��EΪBa(OH)2��DΪKAl(SO4)2����NaHCO3���������ֻ����һ������NaHSO4����BΪNaHSO4��NH3 ? H2Oֻ����KAl(SO4)2������������AΪNH3 ? H2O������������A��B��C��D��E�ֱ�ΪNH3 ? H2O��NaHSO4��NaHCO3��KAl(SO4)2��Ba(OH)2��(1) B��E�Ļ�ѧʽ�ֱ�ΪNaHSO4��Ba(OH)2(2)NH3 ? H2O��������ʣ����ֵ��룬���뷽��ʽΪNH3��H2O NH4++OH-��(3) NaHCO3��KAl(SO4)2����˫ˮ�ⷴӦ����Al(OH)3������CO2���壬��Ӧ�����ӷ���ʽΪAl3++3HCO3-= Al(OH)3��+3CO2����(4) 0.1 mol���ʵ�KAl(SO4)2��Һ�μ�Ba(OH)2��Һ����Al3+ȫ������ʱ�������������0.1molAl(OH)3������0.15molBaSO4���������ɳ��������ʵ���֮�����Ϊ0.25mol��
NH4++OH-��(3) NaHCO3��KAl(SO4)2����˫ˮ�ⷴӦ����Al(OH)3������CO2���壬��Ӧ�����ӷ���ʽΪAl3++3HCO3-= Al(OH)3��+3CO2����(4) 0.1 mol���ʵ�KAl(SO4)2��Һ�μ�Ba(OH)2��Һ����Al3+ȫ������ʱ�������������0.1molAl(OH)3������0.15molBaSO4���������ɳ��������ʵ���֮�����Ϊ0.25mol��
 NH4++OH-��(3) NaHCO3��KAl(SO4)2����˫ˮ�ⷴӦ����Al(OH)3������CO2���壬��Ӧ�����ӷ���ʽΪAl3++3HCO3-= Al(OH)3��+3CO2����(4) 0.1 mol���ʵ�KAl(SO4)2��Һ�μ�Ba(OH)2��Һ����Al3+ȫ������ʱ�������������0.1molAl(OH)3������0.15molBaSO4���������ɳ��������ʵ���֮�����Ϊ0.25mol��
NH4++OH-��(3) NaHCO3��KAl(SO4)2����˫ˮ�ⷴӦ����Al(OH)3������CO2���壬��Ӧ�����ӷ���ʽΪAl3++3HCO3-= Al(OH)3��+3CO2����(4) 0.1 mol���ʵ�KAl(SO4)2��Һ�μ�Ba(OH)2��Һ����Al3+ȫ������ʱ�������������0.1molAl(OH)3������0.15molBaSO4���������ɳ��������ʵ���֮�����Ϊ0.25mol��
��ϰ��ϵ�д�
�����Ŀ