题目内容
在某一溶液中可能含有下列几种离子:K+、Fe3+、Ag+、Ba2+、AlO2—、CO32—、SO32—、SO42—。某该溶液进行有关实验,实验步骤及结果如下:
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH)2溶液并加热,得到白色沉淀丙、气体丙和溶液丙。
④检验气体甲、气体乙、气体丙,都只含有一种成分,而且各不相同。
下列说法正确的是
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH)2溶液并加热,得到白色沉淀丙、气体丙和溶液丙。
④检验气体甲、气体乙、气体丙,都只含有一种成分,而且各不相同。
下列说法正确的是
| A.气体甲可能为CO2或者SO2 |
| B.沉淀丙中一定含有BaCO3,可能含有BaSO4 |
| C.该溶液中肯定存在的离子有K+、AlO2—、SO32—、SO42— |
| D.只根据实验①能得出溶液中一定没有Fe3+、Ag+、Ba2+,K+是否存在无法确定。 |
B
和盐酸反应生成气体的只有CO32—和SO32—,即二者至少含有一种。溶液甲中一定含有盐酸,因此加入NH4HCO3溶液会生成二氧化碳气体,乙是CO2,则甲就是SO2。所以一定含有SO32—,则Fe3+、Ag+、Ba2+就没有,那么K+就一定含有。能与NH4HCO3溶液反应生成沉淀的只有AlO2—,沉淀是氢氧化铝,所以一定含有AlO2—。由于溶液乙中含有NH4HCO3,所以当加入过量Ba(OH)2溶液并加热时一定会生成氨气和碳酸钡沉淀。即丙是氨气,沉淀不一定含有硫酸钡,即无法确定原溶液中是否含有SO42—。答案是B。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
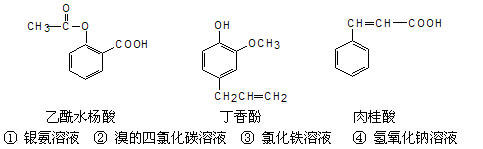
 ”表示生成气体物质,“
”表示生成气体物质,“ ”表示生成沉淀。
”表示生成沉淀。