题目内容
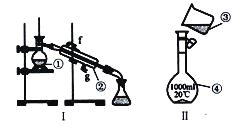
【题目】利用如图所示装置,以NH3作氢源,可实现电化学氢化反应。下列说法错误的是
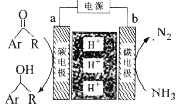
A.a为阴极
B.b电极反应为:2NH3-6e-=N2+6H+
C.电解一段时间后,装置内H+数目增多
D.理论上每消耗1 mol NH3,可生成1.5mol![]()
【答案】C
【解析】
根据图像可知,b极氨气中的N原子化合价由-3变为0价,得电子为电解池的阳极,则b极为阴极,化合价降低得电子;电解质溶液中的氢离子向阴极移动;
A.分析可知, a为阴极得电子,A正确;
B. b电极氨气中的N原子化合价由-3变为0价,生成氮气和氢离子,其电极反应为:2NH3-6e-=N2+6H+,B正确;
C. 电解一段时间后,b电极消耗溶液中的氢离子,装置内H+数目不变,C错误;
D. 理论上每消耗1 mol NH3,消耗溶液中3mol氢离子,发生加成反应,可生成1.5mol![]() ,D正确;
,D正确;
答案为C

【题目】用酸性KMnO4溶液与H2C2O4(草酸)溶液反应研究影响反应速率的因素,一实验小组欲通过测定单位时间内生成CO2的体积,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图所示:
实验序号 | A溶液 | B溶液 |
① | 20mL 0.1mol·L-1H2C2O4溶液 | 30mL 0.01mol·L-1KMnO4溶液 |
② | 20mL 0.2mol·L-1H2C2O4溶液 | 30mL 0.01mol·L-1KMnO4溶液 |
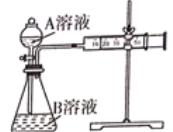
(1)写出该反应的离子方程式__________________________________________。
(2)该实验探究的是________因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是______>______(填实验序号)。
(3)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4-)=______ mol·L-1(假设混合溶液的体积为50mL)。
(4)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定_________________________来比较化学反应速率。
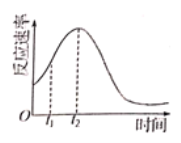
(5)小组同学发现反应速率变化如图,其中t1-t2时间内速率变快的主要原因可能是:①反应放热,②___________________。