题目内容
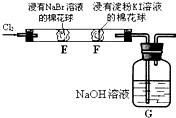 某化学小组用如图所示装置验证卤素单质氧化性的相对强弱.下列说法不正确的是( )
某化学小组用如图所示装置验证卤素单质氧化性的相对强弱.下列说法不正确的是( )分析:由氯气的氧化性强,结合图可知,E处发生Cl2+2Br-=2Cl-+Br2;F处发生Cl2+2Br-=2Cl-+Br2、Br2+2I-=2Br-+I2;G处为尾气处理,发生2OH-+Cl2=ClO-+Cl-+H2O,以此来解答.
解答:解:A.E处发生Cl2+2Br-=2Cl-+Br2,则E处棉花球变成黄色,说明Cl2的氧化性比Br2强,故A正确;
B.F处发生Cl2+2Br-=2Cl-+Br2、Br2+2I-=2Br-+I2,只能说明有碘生成,由于氯气的干扰不能说明Br2的氧化性比I2强,故B错误;
C.由图可知,E处发生反应的离子方程式为:Cl2+2Br-=2Cl-+Br2,故C正确;
D.G处为尾气处理,装置中NaOH溶液与Cl2反应的离子方程式为2OH-+Cl2=ClO-+Cl-+H2O,故D正确;
故选B.
B.F处发生Cl2+2Br-=2Cl-+Br2、Br2+2I-=2Br-+I2,只能说明有碘生成,由于氯气的干扰不能说明Br2的氧化性比I2强,故B错误;
C.由图可知,E处发生反应的离子方程式为:Cl2+2Br-=2Cl-+Br2,故C正确;
D.G处为尾气处理,装置中NaOH溶液与Cl2反应的离子方程式为2OH-+Cl2=ClO-+Cl-+H2O,故D正确;
故选B.
点评:本题考查卤素单质的置换反应及氧化还原反应,明确各处发生的氧化还原反应是解答本题的关键,并注意F处发生两个反应为学生解答的易错点和难点,题目难度中等.

练习册系列答案
相关题目
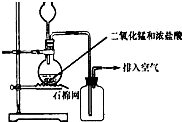 (2007?淄博三模)某化学小组用如图所示装置制取氯气.下列说法不正确的是( )
(2007?淄博三模)某化学小组用如图所示装置制取氯气.下列说法不正确的是( )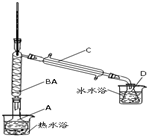 已知:
已知: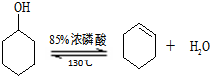
 某化学小组用如图所示装置制取氯气,下列说法不正确的是( )
某化学小组用如图所示装置制取氯气,下列说法不正确的是( )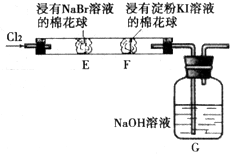 某化学小组用如图所示装置验证卤素单质氧化性的相对强弱.下列说法不正确的是( )
某化学小组用如图所示装置验证卤素单质氧化性的相对强弱.下列说法不正确的是( )