题目内容
【题目】根据要求回答:
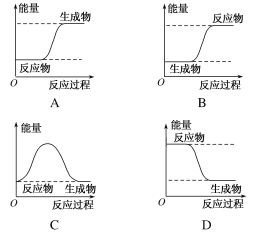
(1)下列各图中,表示反应是吸热反应的是_______
(2)到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。在25 ℃、101 kPa下,16 g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352 kJ的热量,则表示甲醇燃烧的热化学方程式为_____________________________。
(3)化学反应中放出的热能(焓变,ΔH)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ·mol-1
E(H—H)=436 kJ·mol-1
E(Cl—Cl)=243 kJ·mol-1
则E(H—Cl)=________________________________。
(4)已知:
甲醇脱水反应 2CH3OH(g)=CH3OCH3(g)+H2O(g)△H1=-23.9KJ·mol-1
甲醇制烯烃反应 2CH3OH(g)=C2H4(g)+2H2O(g)△H2=-29.1KJ·mol-1
乙醇异构化反应 CH3CH2OH(g)=CH3OCH3(g)△H3=+50.7KJ·mol-1
则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的△H=____________kJ·mol-1
【答案】ACH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l)△H=-704kJ·mol-1432kJ·mol-1-45.5
【解析】
分析: 化学反应都伴随着能量变化,通常表现为热量变化。当反应物所具有的总能量大于生成物所具有的总能量时,反应物转化为生成物的过程中,反应体系就会向环境放出热量,这是放热反应;反之如果反应物具有的总能量小于生成物所具有的总能量时,反应物需要吸收环境的能量才能转化为生成物,这就是吸热反应;依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,结合热化学方程式书写方法,标注物质聚集状态和对应焓变;反应热=反应物总键能-生成物总键能,据此计算;根据盖斯定律计算反应热。
(1)图示可知,A反应过程中反应物总能量低于生成物总能量,B、D反应过程中反应物总能量高于生成物总能量,C反应过程中反应物总能量等于生成物总能量,因此只有A反应过程中的正反应是吸热反应。
(2)16g的甲醇完全燃烧生成CO2和液态水时放出352kJ的热量,32g甲醇即1mol,燃烧生成二氧化碳和液态水放热704kJ,则热化学方程式为:CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) △H=-704kJ·mol-1 ;
(3)H2(g)+Cl2(g)═2HCl(g) △ H=-185kJ/mol,E(H-H)=436kJ/mol,E(Cl-Cl)=243kJ/mol,△ H=反应物键能总和-生成物键能总和得到:-185kJ/mol=436kJ/mol+243kJ/mol-2E(H-Cl),则E(H-Cl)=432kJ/mol;
(4)①2CH3OH(g)=CH3OCH3(g)+H2O(g)△H1=-23.9 kJ/mol
②2CH3OH(g)=C2H4(g)+2H2O(g)△H2=-29.1 kJ/mol
③CH3CH2OH(g)=CH3OCH3(g)△H3=+50.7 kJ/mol根据盖斯定律①-②-③可得:C2H4(g)+H2O(g)=C2H5OH(g)△H=-23.9 kJ/mol +29.1 kJ/mol -50.7 kJ/mol =-45.5kJ/mol。故答案为:-45.5。

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
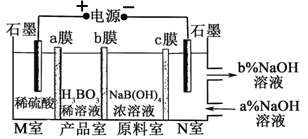
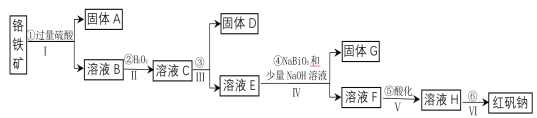
天天向上课时同步训练系列答案【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:
查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42-,自身被还原为Bi(OH)3固体。
ii.
物质 | 开始沉淀的pH | 完全沉淀的pH |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.4 | 4.4 |
Cr(OH)3 | 4.6 | 5.9 |
Fe(OH)2 | 7.5 | 9.7 |
Bi(OH)3 | 0.7 | 4.5 |
回答下列问题:
(1)将铬铁矿矿石粉碎的目的是________________________________________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和___________(填仪器名称)。
(3)写出④反应的化学方程式_____________________________________________。
(4)⑤中酸化是使CrO42-转化为Cr2O72-![]() 写出该反应的离子方程式______。
写出该反应的离子方程式______。
(5)将溶液H经下列操作:蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
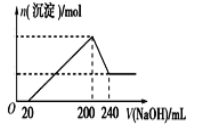
(6)取一定质量的固体D溶解于200 mL的稀硫酸中,向所得溶液中加入5.0 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含Fe化合物的物质的量为___________。
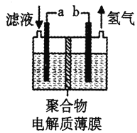
【题目】化学变化中伴随着能量的转化,在理论研究和生产生活中有很重要的作用。
Ⅰ.催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺。
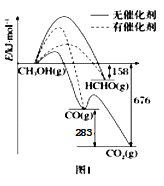
(1)人们常用催化剂来选择反应进行的方向.图1所示为一定条件下1 mol CH3OH 与O2发生反应时.生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。在有催化剂作用下,CH3OH与O2反应主要生成________(填“CO”、“CO2”或“HCHO”);2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H=________。
Ⅱ.第三代混合动力车,可以用电动机,内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。
(2)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,生成1 mol 水蒸气放热550kJ;若1 g水蒸气转化为液态水放热2.5kJ,则辛烷燃烧热的热化学方程式为_____________。

(3)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为: H2+2NiOOH![]() 2Ni(OH)2。
2Ni(OH)2。
根据所给信息判断,混合动力车上坡或加速时.乙电极周围溶液的pH______(填“增大”,“减小”或“不变”),该电极的电极反应式为_______________。
(4)远洋轮船的钢铁船体在海水中易发生电化学有腐蚀中的______腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的______(填“正”或“负”)极相连。
Ⅲ.A、B、C三种强电解质,它们在水中电离出的离子如表所示:
阳离子 | Ag+ Na+ |
阴离子 | NO3- SO42 - Cl- |
如图1所示的装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液。电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如图2所示。据此回答下列问题:
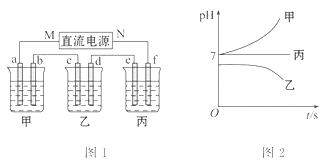
(5)M为电源的______极(填写“正”或“负”),甲为__________(填写化学式)。
(6)计算电极f上生成的气体在标准状况下的体积_________。
(7)写出乙烧杯中的电解池反应______________________。
(8)若电解后甲溶液的体积为25 L,则该溶液的pH为_______。
(9)要使丙恢复到原来的状态,应加入_______g______。(填写化学式)