题目内容
已知:NH3·H2O(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1;强酸、强碱的稀溶液反应的中和热为ΔH=-57.3 kJ·mol-1。则NH3·H2O在水溶液中电离的ΔH等于( )
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+69.4 kJ·mol-1 D.+45.2 kJ·mol-1
解析:选D 根据题意先写出热化学方程式:2NH3·H2O(aq)+H2SO4(aq)===(NH4)2SO4(aq)+2H2O(l) ΔH=-24.2 kJ·mol-1,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。再由盖斯定律得,NH3·H2O(aq)===NH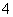 (aq)+OH-(aq) ΔH=+45.2 kJ·mol-1,D正确。
(aq)+OH-(aq) ΔH=+45.2 kJ·mol-1,D正确。

练习册系列答案
相关题目
甲、乙、丙是三种不含相同离子的可溶性强电解质。它们所含离子如下表所示:
| 阳离子 | NH |
| 阴离子 | OH-、NO |
取等质量的三种化合物配制相同体积的溶液,其溶 质物质的量浓度:c(甲)>c(乙)>c(丙),则乙物质可能是( )
质物质的量浓度:c(甲)>c(乙)>c(丙),则乙物质可能是( )
①MgSO4 ②NaOH ③(NH4)2SO4 ④Mg(NO3)2 ⑤NH4NO3
A.①② B.③④
C.③⑤ D.①⑤
 的物质是
的物质是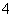 、Na+、Mg2+
、Na+、Mg2+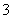 、SO
、SO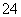
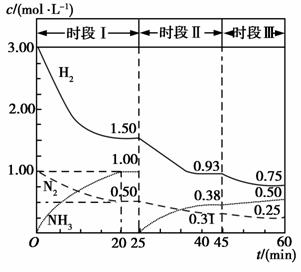
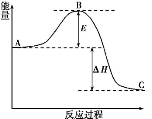 N2(g)+3H2(g)
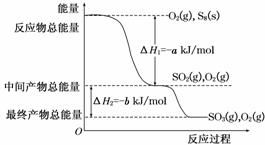
N2(g)+3H2(g) 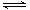 2NH3(g)反应过程的能量变化如下图所示。已知生成1 mol NH3(g)的ΔH=-46 kJ·mol-1。请回答下列问题:
2NH3(g)反应过程的能量变化如下图所示。已知生成1 mol NH3(g)的ΔH=-46 kJ·mol-1。请回答下列问题: