题目内容
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
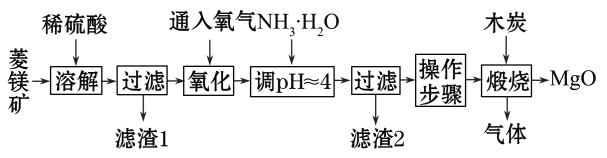
(1)通入O2氧化时,发生反应的离子方程式为________________________。
(2)滤渣2的成分是________(填化学式)。
(3)流程图中“操作步骤”为______________________、过滤等操作,得到MgSO4·7H2O晶体。对MgSO4·7H2O晶体直接加热________(填“能”或“不能”)得到无水MgSO4固体。
(4)长时间加热MgCO3悬浊液后生成Mg(OH)2,该反应的化学方程式为__________________________。
(5)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH | <8.0 | 8.9~9.6 | >9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25 ℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为__________[25 ℃时,Ksp[Mg(OH)2]=5.6×10-12]。
【答案】(1)4Fe2++O2+4H+===4Fe3++2H2O
(2)Fe(OH)3
(3)蒸发浓缩、冷却结晶 能
(4)MgCO3+H2O![]() Mg(OH)2+CO2↑ (5)蓝色
Mg(OH)2+CO2↑ (5)蓝色
【解析】氧气是氧化剂,找出流程中的还原剂只能为Fe2+,通入氧气后溶液中为Fe2+、Mg2+,加入氨水由产品MgO可知Mg2+没有沉淀,Fe3+生成Fe(OH)3沉淀;(3)操作步骤的目的是从硫酸镁溶液中得到MgSO4·7H2O晶体,MgSO4·7H2O晶体受热易失去结晶水,所以不能蒸干;依据MgSO4+2H2O![]() Mg(OH)2+H2SO4,硫酸不挥发,所以水解不能进行到底;(5)由酸碱指示剂可知此题应该求溶液中的pH。Mg(OH)2(s)
Mg(OH)2+H2SO4,硫酸不挥发,所以水解不能进行到底;(5)由酸碱指示剂可知此题应该求溶液中的pH。Mg(OH)2(s) ![]() Mg2+(aq)+2OH-(aq),可知c(OH-)=2c(Mg2+),Ksp[Mg(OH)2]=
Mg2+(aq)+2OH-(aq),可知c(OH-)=2c(Mg2+),Ksp[Mg(OH)2]=![]() c3(OH-)=5.6×10-12,c(OH-)=
c3(OH-)=5.6×10-12,c(OH-)=![]() ×10-4mol·L-1,pH>10。
×10-4mol·L-1,pH>10。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案