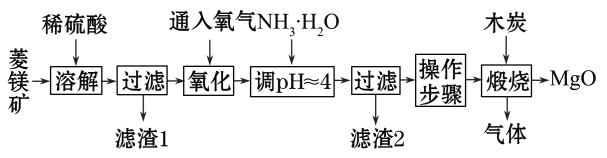
题目内容
【题目】(1)下面列出了几组物质,请将正确的序号填写在空格上。
①金刚石与“足球烯”C60; ②HCHO和CH3CHO; ③CH3CH2OH和CH3OCH3;④CH4和CH3CH2CH3;⑤D与T ; ⑥CH2=CH—CH2—CH3和CH3—CH=CH—CH3;⑦氧气(O2)与臭氧(O3)
同位素_________________;同系物_____________ ;
同素异形体_____________;同分异构体______________。
(2)现有下列六种有机物a.乙烷 b.乙烯 c.苯 d.乙醇 e.乙酸 f.CH2===CH—COOH g.CH2OH(CHOH)4CHO h.乙酸乙酯
①能与Na和NaOH溶液都反应的是_____________。
②分子内所有原子一定在同一平面上的有___________。
③常温下可能与溴水发生加成反应的有_____________。
④在一定条件下能发生酯化反应的有_______________。
⑤能与新制Cu(OH)2悬浊液反应的有________________。
⑥能发生水解反应的有______________。
(3)现有 A:CH3CH2OH; B:CH2OH—CH2OH;
C:CH2OH—CH(OH)—CH2OH三种有机物:
①等物质的量的这三种有机物完全燃烧耗氧量之比为______________;
②写出A与金属钠反应的化学方程式:_____________________________。
③等物质的量的这三种有机物与足量金属钠反应,同温同压下产生氢气的体积比为:__________________________。
④写出B在铜作催化剂的条件下与氧气反应的方程式:_______。
【答案】 ⑤ ②④ ①⑦ ③⑥ ef bc bf defg g h 6:5:7 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ 1:2:3 CH2OH—CH2OH+O2![]() OHC—CHO+2H2O
OHC—CHO+2H2O
【解析】(1)质子数相同、中子数不同的同一种元素的不同核素互为同位素,D与T互为同位素;结构相似、在分子组成上相差一个或n个CH2原子团的有机物互称同系物,HCHO和CH3CHO以及CH4和CH3CH2CH3互为同系物;由同一种元素形成的不同单质互为同素异形体,金刚石与“足球烯”C60以及氧气(O2)与臭氧(O3)互为同素异形体;分子式相同、结构不同的化合物互为同分异构体,CH3CH2OH和CH3OCH3以及CH2=CH-CH2-CH3和CH3-CH=CH-CH3互为同分异构体。
(2)①能与Na和NaOH溶液都反应的是含有羧基的乙酸和丙烯酸。②苯环和碳碳双键均是平面形结构,则分子内所有原子一定在同一平面上的有乙烯和苯。③乙烯和丙烯酸均含有碳碳双键,常温下可与溴水发生加成反应。④含有羟基或羧基的可以发生酯化反应,则在一定条件下能发生酯化反应的有乙醇、乙酸丙烯酸和葡萄糖。⑤含有醛基的有机物能与新制Cu(OH)2悬浊液反应,即葡萄糖可以与新制Cu(OH)2悬浊液反应。⑥乙酸乙酯含有酯基,能发生水解反应。
(3)①根据有机物分子式可知1mol乙醇、乙二醇和丙三醇完全燃烧消耗氧气分别是3mol、2.5mol、3.5mol,所以等物质的量的这三种有机物完全燃烧耗氧量之比为6:5:7;②乙醇与金属钠反应的化学方程式为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑。③三种物质含有的羟基个数分别是1、2、3,则等物质的量的这三种有机物与足量金属钠反应,同温同压下产生氢气的体积比为1:2:3。④乙二醇在铜作催化剂的条件下与氧气反应的方程式为CH2OH+O2![]() OHC-CHO+2H2O。
OHC-CHO+2H2O。

【题目】以Al和不同的铜盐溶液间的反应为实验对象,探索Al与不同铜盐溶液反应的多样性。
实验 | 向试管中加入2ml溶液 | 实验现象 |
| 实验Ⅰ:0.5mol/LCuCl2溶液 | 15s:大量气泡且有红色物质析出 60s:反应进一步加快且反应剧烈放热,液体几乎沸腾 120s:铝片反应完,试管中析出大量蓬松的红色物质 |
实验Ⅱ:0.5mol/LCuSO4溶液 | 15s 无明显现象 60s:铝片表面有极少气泡 120s:有少量气泡溢出,铝片边缘有很少红色物质生成 |
(1)对实验Ⅰ进行研究②④
①实验Ⅰ中生成红色物质的离子方程式为:____________________________
经检验实验Ⅰ中产生的气体为氢气,用离子方程式解释溶液中存在H+的原因:_____________________
③请写出60s后反应进一步加快可能的原因(写出两条)_____________________________
(2)对实验Ⅱ进行研究
实验Ⅱ反应明显比实验Ⅰ缓慢,说明Al与不同的铜盐溶液反应呈现多样性,其原因可能有:
假设一:SO42-对Al与Cu2+的置换反应存在一定的抑制作用。
假设二:________________________
(3)为进一步研究上述假设,设计如下实验:
实验 | 向试管中加入2mL溶液 | 实验现象 |
| 实验Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固体 | 加入 Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
实验Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固体 | 加入Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 | |
实验Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固体 | 未加入 NaCl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 | |
实验Ⅵ:0.5mol/LCuSO4溶液+_________ NH4Cl固体 | 未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
_____________________________________
其中,实验Ⅰ与实验Ⅲ、Ⅳ做对比,结论为:______________________________________
其中,实验Ⅱ与实验Ⅴ、Ⅵ做对比,结论为:______________________________________
(4)请设计实验证明Cl-对Al与H+的反应同样起到相似的作用:_________________