题目内容
【题目】轻质碳酸镁[主要含MgCO3和Mg(OH)2]是制取氧化镁的工业原料。某研究性学习小组用如图所示装置确定轻质碳酸镁的组成。向广口瓶B中加入足量1.00 mol·L-1稀硫酸,充分反应后测得D装置增重0.88 g;向B所得溶液中加入足量NaOH溶液,过滤,将所得沉淀洗涤、低温干燥、称量所得Mg(OH)2固体为1.45 g。
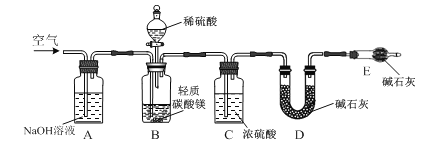
⑴ 反应后需向装置A中缓缓鼓入空气,目的是________。
⑵ 某同学旋转分液漏斗下面的活塞,发现液体不能顺利流下,可能的原因是________。
⑶ 由浓硫酸配制100mL 1.00 mol·L-1的硫酸,下列操作会使所配溶液浓度偏低的是________填字母)。
A.容量瓶使用前未干燥,有少量水残留
B.定容时,俯视容量瓶刻度线
C.加水时超过刻度线,用胶头滴管吸出多余的液体
D.稀释浓硫酸时未冷却至室温就将溶液转移入容量瓶
⑷ 该轻质碳酸镁中MgCO3和Mg(OH)2物质的量的比值为________。
【答案】使生成的二氧化碳气体全部进入D装置,被碱石灰完全吸收 分液漏斗上的玻璃塞未拔去(或未将玻璃塞上的凹槽与漏斗口上的凹槽相对应) C 4:1
【解析】
轻质碳酸镁[主要含MgCO3和Mg(OH)2] 向广口瓶B中加入足量1.00 mol·L-1稀硫酸,充分反应后生成二氧化碳气体,镁离子和水,二氧化碳被浓硫酸干燥后不碱石灰吸收,增重量是二氧化碳的质量。
(1)反应后需向装置A中缓缓鼓入空气,目的是使生成的二氧化碳气体全部进入D装置,被碱石灰完全吸收;
(2)液体不能顺利流下,可能内压大于外压,可能的原因是:分液漏斗上的玻璃塞未拔去(或未将玻璃塞上的凹槽与漏斗口上的凹槽相对应);
(3)有c=n÷v分析;
A.容量瓶使用前未干燥,有少量水残留,对所配溶液浓度没有影响,故错误;
B.定容时,俯视容量瓶刻度线,使溶液的体积偏小,所以浓度偏高,故错误;
C.加水时超过刻度线,用胶头滴管吸出多余的液体,使溶液的体积偏大,浓度偏低,故正确;
D.稀释浓硫酸时未冷却至室温就将溶液转移入容量瓶,液体体积热胀冷缩,使体积偏小,浓度偏高,故错误;
故选:C
(4)二氧化碳的物质的量是n=m÷M=0.88g÷44g/mol=0.02mol,根据碳原子守恒可知:MgCO3的物质的量是0.02mol,氢氧化镁的物质的量是n=m÷M=1.45g÷58g/mol=0.025mol,
根据镁原子守恒可知原氢氧化镁的物质的量是0.005mol,MgCO3和Mg(OH)2物质的量的比值为0.02mol:0.005mol=4:1

 小学期末标准试卷系列答案
小学期末标准试卷系列答案【题目】Ⅰ、在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为____________反应(选填吸热、放热)。
(2)能判断该反应是否达到化学平衡状态的依据是_________。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 _________℃。
Ⅱ、向一体积不变的密闭容器中充入2 mol A、0.6 mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g) ![]() 3C(g),各物质的浓度随时间变化的关系如图1所示,其中如t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件。
3C(g),各物质的浓度随时间变化的关系如图1所示,其中如t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件。
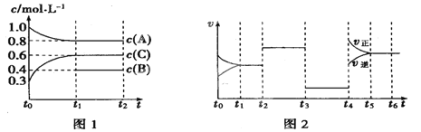
(1)若t1=15 min,则t0~t1阶段以C的浓度变化表示的反应速率V(C)=_____。
(2)t3时改变的条件为___________,B的起始物质的量为_______。
(3)t4~t5阶段,若A的物质的量减少了0.01 mol,而此阶段中反应体系吸收能量为a kJ,写出此条件下该反应的热化学方程式___________________。