题目内容
【题目】利用反应Zn + CuSO4 ═ Cu + ZnSO4 设计一个原电池。
(1) 在下面方格内画出实验装置图________.

(2)指出正极材料可以为_____________, 电极反应式是_______________;负极材料为_____________,电极反应式是_____________________________.
(3)若反应过程中有0.2mol电子通过,则溶解Zn的质量为________g.
【答案】 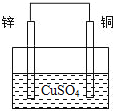 C或Cu或Pt Cu2+ + 2 e- = Cu Zn Zn- 2 e- = Zn2+ 6.5
C或Cu或Pt Cu2+ + 2 e- = Cu Zn Zn- 2 e- = Zn2+ 6.5
【解析】根据反应Zn + CuSO4 ═ Cu + ZnSO4,反应中锌元素的化合价升高,被氧化,要设计成原电池,应该选用锌作负极,选择活泼性比锌差的金属或非金属作正极,选硫酸铜溶液作电解质溶液,据此解答。
(1) 应该选用锌作负极,选择活泼性比锌差的金属或非金属作正极,如铜棒或石墨,选硫酸铜溶液作电解质溶液,实验装置图可以为 ,故答案为:
,故答案为: ;
;
(2)正极材料的活泼性需要比锌差,可以为C或Cu或Pt,正极发生还原反应,电极反应式是Cu2+ + 2 e- = Cu;负极材料为锌,负极发生氧化反应,电极反应式为Zn- 2 e- = Zn2+,故答案为:C或Cu或Pt;Cu2+ + 2 e- = Cu;Zn;Zn- 2 e- = Zn2+;
(3)根据Zn- 2 e- = Zn2+,若反应过程中有0.2mol电子通过,则溶解Zn为0.1mol,质量为0.1mol×65g/mol=6.5g,故答案为:6.5。

【题目】下列实验操作、现象与结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+3KSCN |
B | 用乙醇与浓硫酸反应制乙烯,将产生的气体直接通入酸性高锰酸钾溶液中 | 高锰酸钾溶液的紫红色褪去 | 乙烯能被酸性高锰酸钾氧化 |
C | 向装有X溶液的试管中滴入浓NaOH溶液,将干燥的红色石蕊试纸置于试管口 | 无明显现象 | X溶液中无NH4+ |
D | 常温下,向浓度、体积都相同的Na2CO3和NaHCO3溶液中各滴加1滴酚酞 | 变红,前者 红色更深 | 结合质子的能力:CO32- > HCO3- |
A. A B. B C. C D. D
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。[已知N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4 kJ·mol-1]
2NH3(g)ΔH=-92.4 kJ·mol-1]
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
下列说法正确的是( )
A. 2c1>c3 B. α1+α3=1 C. 2 p2 <p3 D. a+b=92.4
