题目内容
白磷有毒,有实验室可采用CuSO4溶液进行处理,其反应为:11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4,该反应的氧化产物是 ,若有11mol P4反应,则有 mol电子转移.
考点:氧化还原反应,氧化还原反应的电子转移数目计算
专题:氧化还原反应专题
分析:11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4,Cu元素的化合价降低,P元素的化合价既升高又降低,以此来解答.
解答:
解:反应中Cu元素的化合价由+2价降低到+1价,硫酸铜是氧化剂,P4部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,H3PO4为氧化产物,若有11molP4参加反应,其中5mol的P4做氧化剂,60mol硫酸铜做氧化剂,只有6mol的P4做还原剂,由P元素的化合价升高可知,转移电子为6mol×4×(5-0)=120mol,
故答案为:H3PO4;120.
故答案为:H3PO4;120.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注意P失去电子数等于反应中转移的电子数,题目难度中等.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
某电化学实验装置如图所示,下列说法正确的是( )
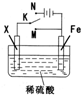

| A、若X为碳棒,开关K置于M处,则溶液中的H+移向Fe极 |
| B、若X为碳棒,开关K置于N处,转移0.2mol e-时析出0.1mol O2 |
| C、若X为铜棒,开关K置于M或N处,均可减缓铁的腐蚀 |
| D、若X为锌棒,开关K置于M或N处,锌电极上反应均为Zn-2e-=Zn2+ |