题目内容
下列有关能量的判断或表示方法正确的是( )
| A.由C(s,石墨)=C(s,金刚石) ΔH=+1.9 kJ·mol-1,可知:石墨比金刚石更稳定 |
| B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多 |
| C.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
| D.2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) |
A
解析

下列图示与对应的叙述相符的是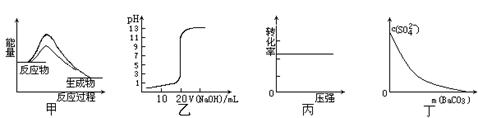
| A.图甲表示使用催化剂后,该反应的ΔH变小 |
| B.图乙表示0.10mol·L-1 NaOH溶液滴定20.00mL0.10mol·L-1 CH3COOH溶液所得到的 滴定曲线 |
C.图丙表示反应H2(g) + I2(g)  2HI(g)中H2的转化率随压强的变化 2HI(g)中H2的转化率随压强的变化 |
| D.图丁表示在饱和Na2SO4溶液中逐步加BaCO3固体后,溶液中c(SO42-)的浓度变化 |
根据下列热化学方程式
(1)C(s)+O2(g)=CO2(g) △H1=-393.5 kJ/mol
(2)H2(g)+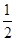 O2(g)=H2O(1) △H2=-285.8 kJ/mol
O2(g)=H2O(1) △H2=-285.8 kJ/mol
(3)CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) △H3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(1)的△H为
| A.△H=+244.1kJ/mol | B.△H=-488.3 kJ/mol |
| C.△H=-996.6 kJ/mol | D.△H=+996.6 kJ/mol |
下列表述中正确的是( )
A.已知2H2(g)+O2(g) 2H2O(g) ΔH="-483.6" kJ/mol,则氢气的燃烧热为241.8 kJ 2H2O(g) ΔH="-483.6" kJ/mol,则氢气的燃烧热为241.8 kJ |
B.由C(石墨,s) C(金刚石,s) ΔH="+11.9" kJ·mol-1可知,金刚石比石墨稳定 C(金刚石,s) ΔH="+11.9" kJ·mol-1可知,金刚石比石墨稳定 |
C.同温同压下,H2(g)+Cl2(g) 2HCl(g)在光照和点燃条件的ΔH不同 2HCl(g)在光照和点燃条件的ΔH不同 |
| D.任何一个化学变化都伴随着能量的变化 |
已知:①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol;②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol。下列结论正确的是( )
| A.碳的燃烧热大于110.5 kJ/mol |
| B.①的反应热为221 kJ/mol |
| C.浓硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH1=+49.0 kJ/mol
②CH3OH(g)+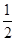 O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
下列说法正确的是( )
| A.1 mol CH3OH完全燃烧放出热量192.9 kJ |
B.②中的能量变化如图所示,则Q=E3-E1 |
| C.H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收热量 |
| D.根据②推知:在25 ℃,101 kPa时,1 mol CH3OH(g)完全燃烧生成CO2和H2O放出的热量应大于192.9 kJ |
下图是N2与H2反应生成NH3的过程中能量变化的曲线图:
下列叙述正确的是( )。
| A.该反应的热化学方程式为N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热减小 |
| D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1 |
发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂。
已知:H2(g)+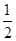 O2(g)=H2O(l)
O2(g)=H2O(l)
ΔH1=-285.8 kJ·mol-1①
H2(g)=H2(l) ΔH2=-0.92 kJ·mol-1②
O2(g)=O2(l) ΔH3=-6.84 kJ·mol-1③
H2O(g)=H2O(l) ΔH4=-44 kJ·mol-1④
下列说法正确的是( )
| A.上述四个反应都是吸热反应 |
| B.1 mol液态H2的能量大于1 mol气态H2的能量 |
| C.H2的燃烧热ΔH为-285.8 kJ·mol-1 |
D.火箭中液氢燃烧的热化学方程式为H2(l)+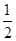 O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1 O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1 |
下列热化学方程式书写正确的是( )
| A.C(s)+O2(g)=CO2(g)ΔH=+393.5 kJ/mol |
| B.2SO+O2=2SO3ΔH=-196.6 kJ/mol |
| C.H2(g)+1/2O2(g)=H2O(l)ΔH=-285.8 kJ/mol |
| D.2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ |