题目内容
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.0.1molN2与足量的H2反应,转移的电子数是0.6NA |
| B.常温下, 0.1 mol·L-1 NH4NO3溶液中含有的氮原子数是0.2NA |
| C.常温常压下,3.2 g O2和3.2 g O3所含氧原子数都是0.2NA |
| D.2.24 L CO和CO2的混合气体中所含的碳原子数为0.1 N A |
C
解析试题分析:A、因为N2与H2的反应是可逆反应,所以0.1mol N2只能反应一部分,转移的电子数小于0.6NA,错误;B、没有给出溶液的体积,无法求算氮原子数目,错误;C、因为O2和O3都是O元素的单质,所以3.2 g O2和3.2 g O3所含氧原子数都是0.2NA,正确;D、没有指明是否为标准状况,无法由气体体积求算物质的量,错误。
考点:本题考查阿伏伽德罗常数的应用。

练习册系列答案
相关题目
若NA表示阿伏加德罗常数,下列说法正确的是
| A.在标准状况下,NA个水分子所占的体积约为22.4L |
| B.5.6g铁与氯气完全反应,失去电子的数目为0.2NA |
| C.1 mol C12发生化学反应,转移的电子数必为2NA |
| D.在标准状况下,22.4L由N2、N2O组成的混合气体中所含有的N的物质的量为2mol |
设NA表示阿伏伽德罗常数的值,下列说法中正确的 ( )
| A.常温下,42 g C2H4和C4H8的混合物中含有的碳原子数为3 NA |
| B.58.5 g氯化钠固体中含有NA个氯化钠分子; |
| C.标况下,11.2 L己烷所含的分子数为0.5 NA; |
| D.1 mol FeCl3完全水解转化为氢氧化铁胶体后生成NA个胶粒; |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A.7.0g乙烯与丙烯的混合物中氢原子数为NA |
| B.常温下,1molC5H12中含有共价键数为17NA |
| C.17g 羟基中含有电子数为10NA |
| D.标准状况下,22.4L苯中含分子数为NA |
在一定体积的容器中加入1.5mol氙气(Xe)和7.5mol氟气,于400℃和2633kPa压强下加热数小时,然后迅速冷却至25℃,容器内除得到一种无色晶体外,还余下4.5mol氟气,则所得无色晶体产物中,氙与氟的原子个数之比是( )
| A.1∶2 | B.1∶3 | C.1∶4 | D.1∶6 |
NA表示阿伏伽德罗常数的值,下列叙述错误的是
| A.2gD216O中含有的质子数、中子数、电子数均为NA |
| B.80g CuO和Cu2S的混合物含有铜原子数一定为NA |
| C.标准状况下,5.6L O2作氧化剂时转移电子数一定为NA |
| D.500mL 2mol·L-1Na2CO3溶液中含C微粒总数一定为NA |
若用NA表示阿伏加德罗常数的值,下列叙述不正确的是
| A.1 mol BrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子数为NA |
| B.锌与一定浓度的浓硫酸反应,产生标准状况下SO2和H2的混合气体22.4 L,锌失去电子数为2NA |
| C.常温常压下,20 g D2O含有的原子总数为3NA |
| D.标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数小于2NA |
用NA表示阿伏加德罗常数。下列说法正确的是
| A.12 g NaHSO4固体中含有的离子数为0.3 NA |
| B.足量Cl2与5.6 g Fe完全反应时,转移的电子数为0.2 NA |
| C.标准状况下,0.56 L 丙烷中含有的共价键数为0.25 NA |
| D.电解精炼铜时每转移NA个电子,阳极溶解32 g铜 |
下列化学用语中,书写或说法正确的是( )
A.硝基苯的结构简式: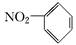 | B.乙醇含有的官能团是—OH,带一个单位负电荷 |
C.丙烷的球棍模型为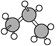 | D.乙酸的分子式:C2H4O |