题目内容
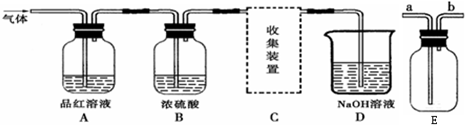
(13分).Ⅰ、研究性学习小组进行SO2的制备及性质探究实验,装置如下图(a为活塞,加热及固定装置已略去)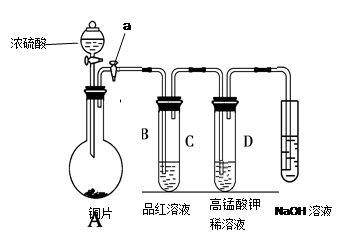
①连接仪器、 、加药品后,打开a,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是:
。
③从品红溶液中观察到的现象说明SO2具有 性。
④高锰酸钾溶液中的实验现象是 。
Ⅱ、上述实验中NaOH溶液用于吸收剩余的SO2生成Na2SO3,Na2SO3是抗氧剂。向烧碱和Na2SO3混合溶液中加入少许溴水,振荡后溶液变为无色。
(1)写出在碱性中Br2氧化Na2SO3的离子方程式
(2)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO42-和Br-的实验报告(步骤可增减)。
限选试剂:2 mol·L-1 HCl;1 mol·L-1 H2SO4;l mol·L-1 BaCl2;l mol·L-1 Ba(NO3)2;
0.1 mol·L-1 AgNO3;CCl4;新制饱和氯水。
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | | 有白色沉淀生成,证明待测液中含SO42-。 |
| 步骤② | | |
| 步骤③ | | |
| …… | | |
(共13分)Ⅰ、①检验装置气密性(1分)
② Cu + 2H2SO4(浓) △ CuSO4 + SO2↑+ 2H2O(2分)
③漂白性(1分)
④溶液由紫红色变为无色(1分)
Ⅱ、(1) SO32- + Br2 + 2 OH- = H2O + SO42- + 2Br- (2分)
(6分)编号 实验操作 预期现象和结论 步骤① 取少量待测液加入试管中,加入过量的2 mol·L-1盐酸,再滴加适量l mol·L-1BaCl2溶液。(2分) 步骤② 方法1:取出步骤①中适量上层清液于试管中,加入适量氯水,观察溶液的颜色。(2分)(若再加入四氯化碳,振荡,静置后观察颜色也可) 溶液呈橙黄色,证明待测液中含Br-。(2分)
(下层液体呈橙红色,证明待测液中含Br-。)方法2:另取少量待测液加入试管中,加入足量的2 mol·L-1盐酸直到不产生气泡为止,再加入少量氯水,观察溶液的颜色。(2分)(若再加入四氯化碳,振荡,静置后观察颜色也可) 溶液呈橙黄色,证明待测液中含Br-。(2分)
(下层液体呈橙红色,证明待测液中含Br-。)
解析

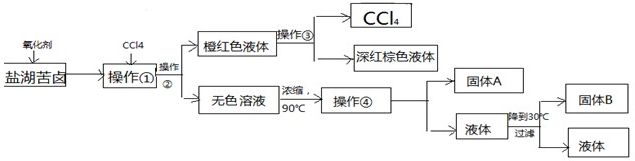
 请根据以上流程,回答相关问题:
请根据以上流程,回答相关问题:
 某研究性学习小组设计了一种给病人输氧时连在氧气钢瓶与呼吸面罩之间的湿化瓶(如图所示),下列连接方式中正确的是( )
某研究性学习小组设计了一种给病人输氧时连在氧气钢瓶与呼吸面罩之间的湿化瓶(如图所示),下列连接方式中正确的是( )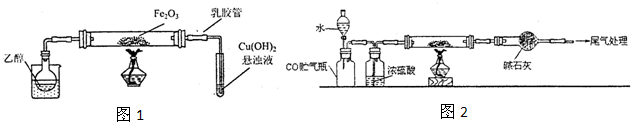
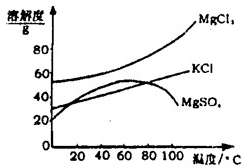
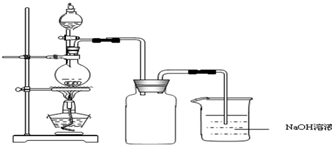 硫酸铜是一种应用极其广泛的化工原料.铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图所示).
硫酸铜是一种应用极其广泛的化工原料.铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图所示).