题目内容
【题目】0.2molNaOH和0.1molCa(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为6.72L(标准状况)时立即停止,则这一过程中,溶液中离子数目和通入CO2气体的体积关系正确的图像是(气体的溶解忽略不计)
A. 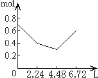 B.
B. 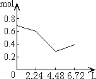
C. 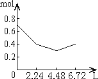 D.
D. 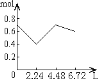
【答案】C
【解析】
n(CO2)=6.72L÷22.4L/mol=0.3mol,通入含有0.2mol氢氧化钠和0.1mol氢氧化钙的溶液中,发生反应:2OH-+CO2=CO32-+H2O,OH-+CO2=HCO3-+H2O,Ca2++CO32-=CaCO3↓,以此解答该题。
n(CO2)=6.72L÷22.4L/mol=0.3mol,含有0.2mol氢氧化钠和0.1mol氢氧化钙的溶液中:n(OH-)=0.2mol+0.1mol×2=0.4mol,n(Na+)=0.2mol,n(Ca2+)=0.1mol,通入CO2,发生反应:2OH-+CO2=CO32-+H2O,OH-+CO2=HCO3-+H2O,Ca2++CO32-=CaCO3↓,设生成xmolCO32-,ymolHCO3-,2x+y=0.4;x+y=0.3,解得x=0.1,y=0.2,所以反应后溶液中含有:n(Na+)=0.2mol,n(HCO3-)=0.2mol,通入含有0.2molNaOH和0.1molCa(OH)2的溶液中,相当于首先发生:Ca2++2OH-+CO2=CaCO3↓,该阶段0.1molCa(OH)2完全反应消耗0.1molCO2,体积为2.24L,离子物质的量减少0.3mol,溶液中离子物质的量为0.7mol-0.3mol=0.4mol,其中含有0.2molOH-、生成0.1molCaCO3;然后发生2OH-+CO2=CO32-+H2O,0.2molOH-完全反应消耗0.1molCO2,体积为2.24L,该阶段离子物质的量减少0.1mol,溶液中剩余离子物质的量为0.4mol-0.1mol=0.3mol,溶液中含有0.2molNa+、0.1molCO32-;再发生CO32-+CO2+H2O=2HCO3-、CaCO3+CO2+H2O=Ca2++2HCO3-,消耗0.1molCO2,体积为2.24L,溶液中离子物质的量增大,溶液中离子为0.6mol,所以图象C符合,答案选C。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案