题目内容
【题目】下列金属中,工业上常用电解法冶炼的是
A.CuB.AgC.FeD.Al
【答案】D
【解析】
A.铜是不活泼金属,工业上常用热还原法冶炼金属铜,故A错误;
B.银是不活泼金属,工业上常用热分解法冶炼金属银,故B错误;
C.铁是较活泼金属,工业上常用热还原法冶炼金属铁,故C错误;
D.铝是活泼金属,工业上常用电解法冶炼金属铝,故D正确;
故选D。

 阅读快车系列答案
阅读快车系列答案【题目】已知反应A(g)+B(g) ![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A. 达到平衡后,B的转化率为50%
B. 增大压强,正、逆反应速率均加快
C. 该反应为吸热反应,升高温度,平衡正向移动
D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1
【题目】某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。已知:
①A 中反应为 KClO3+6HCl(浓) = KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为 Ca(OH)2,其他杂质不参与反应。
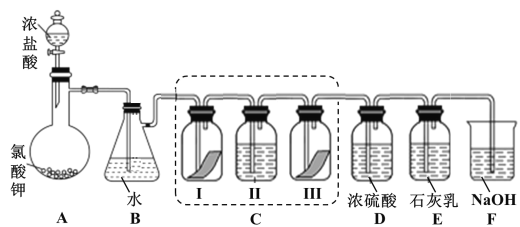
(1)写出 B 装置中反应的化学方程式_______________。实验结束后,立即将 B 中溶液滴几滴在紫色石蕊试纸上,可观察到的现象是______________
(2)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中 I、II、III 处依次放入的物质正确的是_________(填编号)。
编号 | I | II | III |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
B | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(3)待 E 中物质完全反应后,经过一系列加工处理,得到漂白粉样品,其主要成份为_________、____________(填化学式)。
(4)F 装置的作用是(用离子方程式表示)_____________
(5)为测定(3)中所得漂白粉的有效成份含量。称取 a g 漂白粉样品溶解,往所得溶液中通入 CO2 至不再产生沉淀为止,该过程的化学方程式为_____________。若反应生成沉淀的物质的量为 b mol,则该漂白粉中有效成份的质量分数为_________________(用含 a、b 的式子表示)。