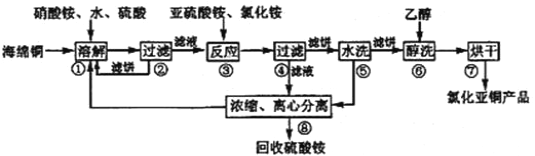
��Ŀ����
����Ŀ�������Ǿ����Դ���⣬�����Ǻ�ˮ��Դ�ۺ����õIJ�������ͼ��

��1���Ӻ�ˮ�л�ô��εķ�����____________________��
��2�������к���Ca2+��Mg2+��SO42- ���������ӣ���ȡ���εĹ����������γ�ȥ��Щ���ӣ����ӳ����Լ�����������������Һ��_________________��________________��
��3�����з�Ӧ�Ļ�ѧ����ʽ��________________��
��4�����з�Ӧ�����ӷ���ʽ��________________________������1molBr2ת�Ƶ���________mol��
��5�������Ϲ��̿�֪��Cl2��SO2��Br2����������ǿ������˳����________________��
���𰸡� ���� �Ȼ�����Һ��̼������Һ ������Һ 2MgCl2![]() Mg��Cl2�� 2Br����Cl2=Br2��2Cl�� 2 Cl2>Br2>SO2
Mg��Cl2�� 2Br����Cl2=Br2��2Cl�� 2 Cl2>Br2>SO2
����������1���Ӻ�ˮ�л�ô��εķ�������������2��þ���ӻ������������ӡ�̼����������ɳ����������ӻ���̼����������ɳ�������������ӻ��뱵�������ɳ��������˺����������Գ�ȥ������̼���ƺ��������ƣ���Ҫ���μ����Թ�����NaOH��BaCl2 ��Na2CO3�����ˡ�����Һ�м����������������������ɣ���������Һ����Ũ������ȴ�ᾧ���õ����Σ���3��������ڵ��Ȼ�þ�õ�����þ������ʽΪ2MgCl2![]() Mg��Cl2������4����������ǿ�����������廯������Ϊ������������ʽΪ2Br����Cl2=Br2��2Cl�������ݷ���ʽ��֪����1molBr2 ת�Ƶ���2mol���ӣ���5���������ܰ�SO2����Ϊ���ᣬ����������ԭ��Ӧ����������������ǿ����������������Կ�֪Cl2��SO2��Br2 ����������ǿ������˳����Cl2>Br2>SO2��
Mg��Cl2������4����������ǿ�����������廯������Ϊ������������ʽΪ2Br����Cl2=Br2��2Cl�������ݷ���ʽ��֪����1molBr2 ת�Ƶ���2mol���ӣ���5���������ܰ�SO2����Ϊ���ᣬ����������ԭ��Ӧ����������������ǿ����������������Կ�֪Cl2��SO2��Br2 ����������ǿ������˳����Cl2>Br2>SO2��

 ��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д� �����������Ż�ѧϰϵ�д�
�����������Ż�ѧϰϵ�д�