题目内容
【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
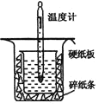
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是______;
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用________。
(3)若改用60mL0.25mol·L-1H2SO4和50mL0.55mol·L-1NaOH溶液进行反应与上述实验相比,所放出的热量________(填“相等”、“不相等”)。
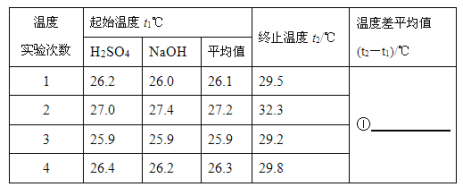
(4)50mL0.55mol/L NaOH溶液和50mL0.25mol/L硫酸溶液的实验数据如下表:
请填写下表中的空白:______
②近似认为50mL0.55mol/LNaOH溶液和50mL0.25 mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热ΔH=______kJ/mol(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是______。
a.实验装置保温.隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【答案】环形玻璃搅拌棒 隔热,减少热量的损失 不相等 3.4 -56.8 acd
【解析】
(1)根据量热计的构造来判断该装置的缺少仪器;
(2)中和热测定实验成败的关键是减少热量散失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(4)①先计算出每次试验操作测定的温度差,然后舍弃误差较大的数据,最后计算出温度差平均值;
②根据Q= cm△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热;
③a.实验装置保温、隔热效果必须好;
b.用温度计测定NaOH溶液起始温度后,要将温度计回零直再测定H2SO4溶液的温度;
c.若分多次把NaOH溶液倒入盛有硫酸的小烧杯中,会导致散失过多的热量;
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,使t1偏大。
(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;
(2)中和热测定实验成败的关键是保温工作,在大小烧杯之间填满碎纸条的作用是隔热,减少实验过程中的热量损失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,开始时取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL发生反应:2NaOH+H2SO4=Na2SO4+2H2O,NaOH过量,以H2SO4为标准计算反应过程中放出的热量;而若用60mL0.25mol/LH2SO4溶液跟50mL0.55mol/LNaOH溶液进行反应,硫酸过量,以NaOH为标准计算,与上述实验相比,生成水的量增多,所放出的热量偏高,故两次反应所放出的热量不相等;
(4)①数据处理:第一次测定温度差为:(29.5-26.1)℃=3.4℃,
第二次测定的温度差为:(32.3-27.2)℃=5.1℃,
第三次测定的温度差为:(29.2-25.9)℃=3.3℃,
第四次测定的温度差为:(29.8-26.3)℃=3.5℃,
其中第二次的温度差误差较大,应该舍弃,其它三次温度差的平均值为:![]() ℃
℃
②50mL0.55mol/L氢氧化钠与50mL0.25mol/L硫酸溶液进行中和反应,生成水的物质的量为n(H2O)=0.05L×0.50mol/L=0.025mol,溶液的质量为:100mL×1g/cm3=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为:Q= cm△T=4.18J/(g℃)×100g×3.4℃=1421.2J,即1.4212kJ,所以实验测得的中和热△H=-![]() =--56.8 kJ/mol;
=--56.8 kJ/mol;
③a.实验装置保温、隔热效果必须好,否则测定结果偏小,a正确;
b.量取NaOH溶液的体积时仰视读数,则NaOH的体积偏大,以NaOH为标准反应放出的热量多,使溶液温度升高的多,b错误;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,否则会导致较多热量散失,c正确;
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,使反应起始时溶液的温度高,最终导致溶液平均升高的温度少,导致中和热偏高,d正确;
故合理选项是acd;