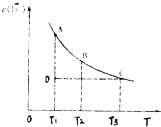
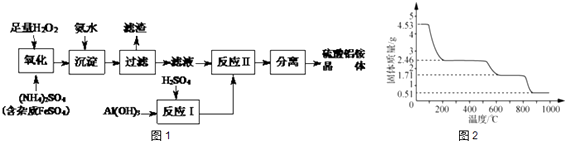
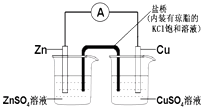
题目内容
【题目】TiO2![]() TiCl4
TiCl4 ![]() Ti
Ti
已知:①C(s)+O2(g)===CO2(g);ΔH=-393.5kJ·mol-1
②2CO(g)+O2(g)===2CO2(g);ΔH=-566kJ·mol-1
③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g);ΔH=+141kJ·mol-1,则TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH=__________。反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由_______________________________________________________________________________________。
【答案】-80kJ·mol-1 防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用
【解析】根据盖斯定律:①×2-②+③得:
ΔH=(+141kJ·mol-1)+(-393.5kJ·mol-1)×2-(-566kJ·mol-1)=-80kJ·mol-1;Mg在高温下易和空气中的成分反应,所以应在Ar气氛中进行。

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目