��Ŀ����
����Ŀ���������������մɡ����ӡ�����ҽҩ�ȷ����й㷺����;������ͨ��������茶����ȷֽ�õ�[��֪��������茶���Ļ�ѧʽΪAl2��NH4��2��SO4��424H2O����Է�������Ϊ906]���Ʊ�������茶����ʵ���������£�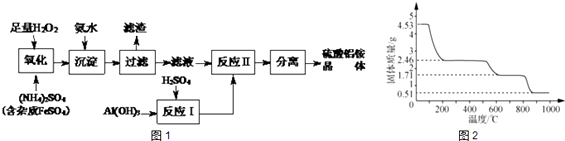
��1��H2O2����FeSO4�����ӷ���ʽΪ ��
��2�����백ˮ��Ŀ���� �� �仯ѧ��Ӧ����ʽΪ ��
��3����Ҫ��֤��Ʒ�Ĵ��ȣ����������백ˮ�������Ƿ��������ʵ������ǣ����Թ�ȡ������Һ�� �� ��˵�������ѳ�����
��4�����������У������롱�������IJ�������Ϊ���������ˡ�ϴ�ӡ���������������茶�����·ֽ�Ļ�ѧ����ʽ��2Al2��NH4��2��SO4��424H2O�T Al2O3+NH3��+SO3��+ ��
��5��ȡ4.53g ������茶�����ȷֽ⣬����ʣ��0.51g Al2O3���壮���ȹ����У������������¶ȵı仯��ͼ2��ʾ�������ȷ��400��ʱ�������δ�ֽ⣩ʣ�����ɷֵĻ�ѧʽΪ��H��1 N��14O��16 Al��27 S��32��
���𰸡�
��1��H2O2+2Fe2++2H+�T2 Fe3++2H2O
��2����������Fe3+��Fe2��SO4��3+6NH3?H2O�T2Fe��OH��3��+3��NH4��2SO4
��3���Ӽ���KSCN��Һ������Һ�����ɫ
��4������Ũ������ȴ�ᾧ��2��4��8��50H2O
��5����NH4��2Al2��SO4��4?H2O
���������⣺�ɹ������̿�֪������������⽫��Һ��Fe2+����ΪFe3+ �� ���백ˮ������ҺpHֵ��ʹFe3+ת��ΪFe��OH��3���˳�ȥ�����˺���Һ��Ҫ������泥����������������Ϸ�Ӧ������������Һ���ٽ�����狀���������Һ��Ϸ�Ӧ��������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����Ȳ��������յõ�������茶��壮
��1.������������⽫��Һ��Fe2+����ΪFe3+ �� ��Ӧ���ӷ���ʽΪ��H2O2+2Fe2++2H+�T2 Fe3++2H2O�����Դ��ǣ�H2O2+2Fe2++2H+�T2 Fe3++2H2O��
��2.�����백ˮ������ҺpHֵ��Fe3+ʹת��ΪFe��OH��3 �� ��Ӧ����ʽΪ��Fe2��SO4��3+6NH3H2O�T2Fe��OH��3��+3��NH4��2SO4���Դ��ǣ���������Fe3+��Fe2��SO4��3+6NH3H2O�T2Fe��OH��3��+3��NH4��2SO4��
��3.�����˺����Һ�п��ܺ���Fe3+ �� ȡ������Һ���Թ��У��Ӽ���KSCN��Һ������Һ�����ɫ���������ѳ��������Դ��ǣ��Ӽ���KSCN��Һ������Һ�����ɫ��
��4.�������С����롱�Ǵ���Һ�л�þ��壬����Ϊ����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����ȣ���Ӧ�и�Ԫ�ػ��ϼ�δ�䣬û�з���������ԭ��Ӧ������ԭ���غ㣬��֪ȱ������Ϊˮ����ƽ��Ӧ����ʽΪ��2Al2��NH4��2��SO4��424H2O�T2Al2O3+4NH3��+8SO3��+50H2O�����Դ��ǣ�����Ũ������ȴ�ᾧ��2��4��8��50H2O��
��5.��4.53g������茶�������ʵ���Ϊ ![]() =0.01mol��
=0.01mol��
4.53g������茶�����ˮ������Ϊ0.01mol��12��18g/mol=2.16g��
����400��ʱ�����������١�m=4.53g��2.46g=2.07g��2.16g
ʣ������нᾧˮ�����ʵ���Ϊ ![]() =0.005mol��
=0.005mol��
ʣ�������n[��NH4��Al��SO4��2]��n��H2O��=0.01mol��0.005mol=2��1��
��400��ʱʣ�����ɷֵĻ�ѧʽΪ��NH4��2Al2��SO4��4H2O�����Դ��ǣ���NH4��2Al2��SO4��4H2O��

 ���100��1�ž�ϵ�д�
���100��1�ž�ϵ�д�����Ŀ����֪��1 mol������к���2 mol Si��Si������ҵ�Ͽ�ͨ�����з�Ӧ��ȡ�ߴ��裺SiCl4(g)��2H2(g)![]() Si(s)��4HCl(g)�������±��оٵĻ�ѧ���ļ������ݣ��жϸ÷�Ӧ�ķ�Ӧ��(��H)Ϊ(����)
Si(s)��4HCl(g)�������±��оٵĻ�ѧ���ļ������ݣ��жϸ÷�Ӧ�ķ�Ӧ��(��H)Ϊ(����)
��ѧ�� | Si��O | Si��Cl | H��H | H��Cl | Si��Si | Si��C |
����/kJ��mol��1 | 460 | 360 | 436 | 431 | 176 | 347 |
A����412 kJ��mol��1 B����412 kJ��mol��1
C����236 kJ��mol��1 D����236 kJ��mol��1




