题目内容
【题目】短周期元素A、B、C,在周期表中所处的位置如图所示。A、B、C三种元素原子质子数之和为32。D元素原子的最外层电子数为其次外层电子数的2倍。则下列说法正确的是

A. 元素D形成的气态氢化物一定是正四面体型分子
B. B、C两种元素可形成BC6型化合物,该化合物在空气中能燃烧
C. 四种元素形成的气态氢化物中,C元素形成的氢化物的稳定性最大
D. A、B两种元素的气态氢化物均能与它们对应的最高价氧化物对应的水化物发生反应,且反应类型相同
【答案】C
【解析】设A元素原子的质子数为x,根据A、B、C在周期表中的相对位置,B元素原子的质子数为x+9,C元素原子的质子数为x+2,则x+x+9+x+2=32,解得x=7,A为N元素,B为S元素,C为F元素;D元素原子的最外层电子数为其次外层电子数的2倍,D为C元素。A,D为C元素,C形成的气态氢化物有CH4、CH2=CH2、CH![]() CH等,CH4为正四面体型、CH2=CH2中2个C和4个H共平面、CH
CH等,CH4为正四面体型、CH2=CH2中2个C和4个H共平面、CH![]() CH中2个C和2个H共直线,A项错误;B,B、C形成的BC6型化合物为SF6,SF6稳定,不能在空气中燃烧,B项错误;C,四种元素中F的非金属性最强,HF最稳定,C项正确;D,N的气态氢化物为NH3,N的最高价氧化物对应水化物为HNO3,NH3与HNO3发生化合反应生成NH4NO3,S的气态氢化物为H2S,S的最高价氧化物对应水化物为H2SO4,H2S与浓H2SO4发生氧化还原反应生成S、SO2和H2O,反应类型不相同,D项错误;答案选C。
CH中2个C和2个H共直线,A项错误;B,B、C形成的BC6型化合物为SF6,SF6稳定,不能在空气中燃烧,B项错误;C,四种元素中F的非金属性最强,HF最稳定,C项正确;D,N的气态氢化物为NH3,N的最高价氧化物对应水化物为HNO3,NH3与HNO3发生化合反应生成NH4NO3,S的气态氢化物为H2S,S的最高价氧化物对应水化物为H2SO4,H2S与浓H2SO4发生氧化还原反应生成S、SO2和H2O,反应类型不相同,D项错误;答案选C。

【题目】氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应 | 大气固氮 N2(g)+O2(g) | 工业固氮 N2(g)+3H2(g) | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于_______(填“吸热”或“放热”)反应。
②分析数据可知:现代工业生产不采用“大气固氮”原理的原因:_______。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因______________。
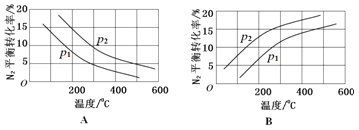
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,下图所示的图示中,正确的是____(填“A”或“B”);比较P1、P2的大小关系_______。
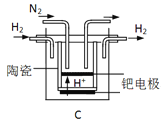
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是__________。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g),则其反应热△H=________。(已知:N2(g)+3H2(g)
4NH3(g)+3O2(g),则其反应热△H=________。(已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g)
2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g)![]() 2H2O(l) △H=-571.6kJ·mol-1)
2H2O(l) △H=-571.6kJ·mol-1)
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、n、p是由这些元素组成的二元化合物,W2、X2、Z2分别是元素W、X、Z的单质。己知:Ⅰ.一定条件下某密闭容器中可发生反应:aX2+bW2![]() cm,反应过程中物质的浓度变化如下:
cm,反应过程中物质的浓度变化如下:
X2 | W2 | m | |
起始浓度/mol·L-1 | 0.4 | 0.4 | 0 |
平衡浓度/ mol·L-1 | 0.3 | 0.1 | 0.2 |
Ⅱ.它们可发生如下反应:2m(g)+3Z2(g)=6n(g)+X2(g);4n(g)+Y2(g)![]() 2p(l)+2Z2(g)。下列说法正确的是
2p(l)+2Z2(g)。下列说法正确的是
A. 原子半径:W<X<Y B. m、n、p三种物质均为共价化合物
C. X的氧化物一定是无色气体 D. a:b:c=3:1:2