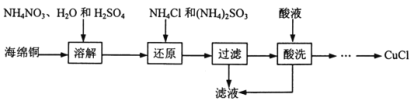
题目内容
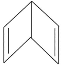
【题目】意大利科学家获得了极具研究价值的![]() 分子结构如图所示
分子结构如图所示![]() ,以下有关物质结构的说法正确的是( )
,以下有关物质结构的说法正确的是( )

A.N均是以![]() 杂化,
杂化,![]() 均为
均为![]() 键
键
B.N的电负性大于O,所以![]() 的沸点低于
的沸点低于![]()
C.![]() 为原子晶体,每个N的配位数为3
为原子晶体,每个N的配位数为3
D.N原子核外有5个未成对电子
【答案】A
【解析】
A.由图可知N4中每个N形成3个共价键,还含有一对孤电子,则其价层电子对数为4,所以属于sp3杂化,N与N之间均为单键,即![]() 键,故A正确;
键,故A正确;
B.同一周期从左到右,电负性逐渐增强,所以N的电负性小于O,所以NH3中形成的氢键比H2O中氢键弱,则NH3的沸点低于H2O,故B错误;
C. N4晶体存在单个分子,属于分子晶体,不是原子晶体,N4中每个N与另外3个N形成共价键,所以配位数为3,故C错误;
D. N原子核外有7个电子,分别位于1s、2s、2p轨道,其轨道排布式为![]() ,所以N原子核外有3个未成对电子,故D错误;
,所以N原子核外有3个未成对电子,故D错误;
答案选A。

【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为 -69℃和58℃,写出该反应的热化学方程式___________。
(2)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9∶1,其电子式为______________。
(3)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价的含氧酸盐,消耗1.0L 2.2molL-1NaOH溶液和1.0molO2,则两种气体中相对分子质量小的气体物质的量为___________。
【题目】研究NO2、NO、SO2、CO等大气污染气体的处理具有重要意义。利用反应6NO2(g)+8NH3(g)![]() 7N2(g)+12H2O(g)可处理NO2。
7N2(g)+12H2O(g)可处理NO2。
(1)在2L的密闭容器中,2分钟内,上述反应混合物的物质的量增加了0.25mol,则2分钟内v(NH3)=______。
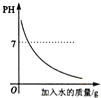
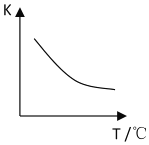
(2)该反应的化学平衡常数表达式K=______;已知该反应平衡常数(K)与温度(T)的关系如图所示,若升高温度,则v正反应______v逆反应(填“大于”、“小于”或“等于”);反应达到平衡后若缩小反应容器体积,其它条件不变,则混合气体的平均式量将______(填“变大”、“变小”或“不变”)。
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学收集某地的雨水进行实验,每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
测定时间/h | 0 | 1 | 2 | 3 | 4 |
雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
(3)请写出上述pH变化的原因______。
(4)有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是______(填编号)。
(5)向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀,用电离平衡原理解释上述现象。______。