题目内容
17.把8g铁片放入100g硫酸铜溶液中,过一会儿取出该铁片,发现铁片经洗涤干燥后质量增重到了8.8g,试求有多少g还原剂参加了反应?(相对原子质量:Fe-56、Cu-64、O-16、H-1、S-32)分析 Fe和硫酸铜溶液发生置换反应Fe+CuSO4=FeSO4+Cu,析出Cu的质量大于溶解Fe的质量,导致反应后Fe片质量增加,根据差量法分析解答.
解答 解:Fe和硫酸铜溶液发生置换反应Fe+CuSO4=FeSO4+Cu,析出Cu的质量大于溶解Fe的质量,导致反应后Fe片质量增加,该反应中Fe是还原剂,设参加反应的Fe的质量是x,
Fe+CuSO4=FeSO4+Cu质量增加
56g (64-56)g
x (8.8-8)g
56g:(64-56)g=x:(8.8-8)g
x=$\frac{(8.8-8)g×56g}{(64-56)g}$=5.6g,
答:有5.6g还原剂参加反应.
点评 本题考查氧化还原反应有关计算,侧重考查学生分析计算能力,采用差量法分析解答即可,题目难度不大.

练习册系列答案
相关题目
7.相对分子质量为M的某物质,在室温下溶解度为$\frac{Sg}{100g}$水,此时测得该物质饱和溶液的密度为ρg/cm3,则该饱和溶液的物质的量的浓度是( )
| A. | $\frac{M}{10s•ρ}$mol/L | B. | $\frac{1000s•ρ}{M(100+s)}$mol/L | ||
| C. | $\frac{10s•ρ}{M}$mol/L | D. | $\frac{M(100+s)}{1000s•ρ}$mol/L |
8.某校化学课外研究小组为研究浓硫酸与金属M 反应的气体生成物,进行了下列实验活动:
【提出假设】
假设1:气体生成物只有SO2;
假设2:气体生成物只有H2;
假设3:气体生成物是SO2和H2的混合气体.
【实验验证】
实验装置及实验中使用的试剂如图:
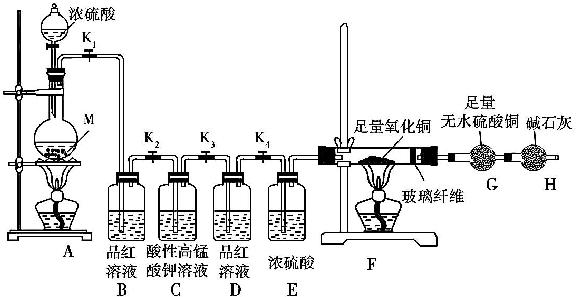
(1)在装入药品前,甲同学检查装置A的气密性,方法是关闭弹簧夹K1,打开分液漏斗活塞,向分液漏斗中注入适量水,若分液漏斗滴下水的速度逐渐变慢,直至停止,则证明装置A的气密性良好.
(2)乙同学通过所学知识排除了上面提出的一个假设,他排除的是假设2,理由是浓硫酸具有强氧化性,在加热的条件下能被金属还原为SO2.
(3)如果实验中观察到装置B 中溶液褪色,装置F 和装置G 中无明显变化,则假设1成立,实验测得消耗金属M 和浓硫酸的物质的量之比为1:2,则在M的硫酸盐中,M元素的化合价为+2
(4)如果假设3正确,填写下表中的实验现象:
(5)装置C的作用是除去可能未反应完的SO2,装置D 的作用是检验SO2是否已除净.
(6)如果装置A中放入的金属M 的质量为11.2g,加入适量浓硫酸,反应完成后,装置B 中溶液褪色,装置A 中金属无剩余;反应后G的质量增加了0.9g;取少量装置A 中溶液稀释,分为两份,一份滴加KSCN 溶液,溶液变红色,另一份滴加酸性KMnO4 溶液,溶液褪色.如果装置A中溶液内的金属离子浓度相等,则装置A 中烧瓶内发生反应的总化学方程式是4Fe+9H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2FeSO4+Fe2(SO4)3+4SO2↑+H2↑+8H2O.
【提出假设】
假设1:气体生成物只有SO2;
假设2:气体生成物只有H2;
假设3:气体生成物是SO2和H2的混合气体.
【实验验证】
实验装置及实验中使用的试剂如图:

(1)在装入药品前,甲同学检查装置A的气密性,方法是关闭弹簧夹K1,打开分液漏斗活塞,向分液漏斗中注入适量水,若分液漏斗滴下水的速度逐渐变慢,直至停止,则证明装置A的气密性良好.
(2)乙同学通过所学知识排除了上面提出的一个假设,他排除的是假设2,理由是浓硫酸具有强氧化性,在加热的条件下能被金属还原为SO2.
(3)如果实验中观察到装置B 中溶液褪色,装置F 和装置G 中无明显变化,则假设1成立,实验测得消耗金属M 和浓硫酸的物质的量之比为1:2,则在M的硫酸盐中,M元素的化合价为+2
(4)如果假设3正确,填写下表中的实验现象:
| 装置 | B | F | G |
| 实验现象 | |||
(6)如果装置A中放入的金属M 的质量为11.2g,加入适量浓硫酸,反应完成后,装置B 中溶液褪色,装置A 中金属无剩余;反应后G的质量增加了0.9g;取少量装置A 中溶液稀释,分为两份,一份滴加KSCN 溶液,溶液变红色,另一份滴加酸性KMnO4 溶液,溶液褪色.如果装置A中溶液内的金属离子浓度相等,则装置A 中烧瓶内发生反应的总化学方程式是4Fe+9H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2FeSO4+Fe2(SO4)3+4SO2↑+H2↑+8H2O.
5.表中,对陈述I、Ⅱ的正确性及其有无因果关系的判断都正确的是( )
| 选项 | 陈述I | 陈述Ⅱ | 判断 |
| A | 铜绿的主要成分是碱式碳酸铜 | 可用稀盐酸除铜器表面的铜绿 | Ⅰ对;Ⅱ对 无 |
| B | 铜绿的主要成分是碱式碳酸铜 | 铜制容器可以盛放浓硫酸 | I对;Ⅱ对;有 |
| C | 向硫酸铜溶液通足量氨气.有深蓝色沉淀产生,过滤后灼烧滤渣,最后变成黑色固体 | 把铜丝放在酒楕灯火焰上灼烧铜丝表面变黑 | I对;Ⅱ对;有 |
| D | 蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 | 硫酸铜溶液可用作游泳池的消毒剂 | 错;Ⅱ对;无 |
| A. | A | B. | B | C. | C | D. | D |
6.写出硫代硫酸钠溶液与稀硫酸反应的化学方程式Na2S2O3+H2SO4═Na2SO4+SO2+S↓+H2O
下列各组实验中最先出现浑浊的是D
下列各组实验中最先出现浑浊的是D
| 实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
7.下表列出了A-R9种元素在周期表中的位置:
(1)这9种元素中,化学性质最不活泼的是Ar.(填元素符号)
(2)D元素的氧化物与氢氧化钠反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(3)写出E 与F形成的两种化合物的电子式 ;
;
(4)用电子式表示B、H两元素形成化合物的过程 ;
;
(5)G元素和H元素两者核电荷数之差是18.
(6)写出E元素的原子核外电子排布图 ,H元素的原子核外电子排布式1s22s22p63s22s23p63d104s24p5.
,H元素的原子核外电子排布式1s22s22p63s22s23p63d104s24p5.
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | ⅤⅢ0 | |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(2)D元素的氧化物与氢氧化钠反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(3)写出E 与F形成的两种化合物的电子式
 ;
;
(4)用电子式表示B、H两元素形成化合物的过程
 ;
;(5)G元素和H元素两者核电荷数之差是18.
(6)写出E元素的原子核外电子排布图
 ,H元素的原子核外电子排布式1s22s22p63s22s23p63d104s24p5.
,H元素的原子核外电子排布式1s22s22p63s22s23p63d104s24p5.