题目内容
硫元素的化合物在生产、生活中有着广泛的应用。
(1)400℃,1.01× Pa下,容积为1.0L的密闭容器中充入0.5molSO2,
(g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g)
Pa下,容积为1.0L的密闭容器中充入0.5molSO2,
(g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g) 2SO3(g)
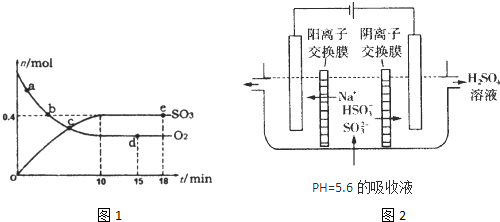
△H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示
2SO3(g)
△H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示 。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
A.a点时刻的正反应速率比b点时刻的大
B.c点时刻反应达到平衡状态
C.d点和e点时刻的c(O2)相同
D.若5 00℃,1.01×105Pa下,反应达到平衡时,n( SO3) 比图中e点时刻的值大
(2)用NaOH溶液吸收工业废气中的SO2,当吸收液失去吸收能力时,25℃时测得溶液的pH=5.6,溶液中Na+,H+, HSO3-,SO32-离子的浓度由大到小的顺序是__________________。
(3)可通过电解法使(2)中的吸收液再生而循环利用(电极均为石墨电极),其工作示意图如下:

HSO3-在阳极室反应的电极反应式为________________________,阴极室的产物_________________。
(共12分)(1)(6分)160 (mol·L-1)-1(2分); 0.04 mol·L-1·min-1(2分);AC(2分)
(2)(2分)c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
(3)(4分)HSO3-+H2O-2e-=SO42-+3H+ (2分) H2、NaOH(2分)
【解析】
试题分析:(1)根据图像可知,反应进行到10min时反应达到平衡状态,平衡时三氧化硫的物质的量是0.4mol,其浓度是0.4mol/L,则
2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
起始浓度(mol/L) 0.5 0.3 0
转化浓度(mol/L) 0.4 0.2 0.4
转化浓度(mol/L) 0.1 0.1 0.4
所以该反应的平衡常数K=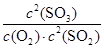 =
= =160
=160
0到10 min内用SO2表示的平均反应速率0.4mol/L÷10min=0.04 mol·L-1·min-1。
A、a点时刻反应物的浓度大于b点时刻反应物的浓度,所以a点时刻的正反应速率比b点时刻的大,A正确;
B、c点时刻正逆反应速率不相等,所以反应没有达到平衡状态,B不正确;
C、d点和e点时刻的平衡状态都是相同的,所以c(O2)相同,C正确;
D、正方应是放热反应,所以升高温度平衡向逆反应方向移动,所以若5 00℃,1.01×105Pa下,反应达到平衡时,n( SO3) 比图中e点时刻的值小,D不正确,答案选AC。
(2)当吸收液失去吸收能力时,反应中生成亚硫酸氢钠。25℃时测得溶液的pH=5.6,这说明HSO3-的电离程度大于HSO3-的水解程度,所以溶液中Na+,H+, HSO3-,SO32-离子的浓度由大到小的顺序是c(Na+)>c(HSO3-)>c(H+)>c(SO32-)。
(3)电解池阳极失去电子,发生氧化反应。阴极得到电子,发生还原反应。所以HSO3-在阳极室反应的电极反应式为HSO3-+H2O-2e-=SO42-+3H+。阴极是溶液中的氢离子得到电子,生成氢气,同时破坏阴极周围水的电离平衡,所以阴极产物是氢气和氢氧化钠。
考点:考查电离平衡常数和反应速率的有关计算;平衡状态以及外界条件对平衡状态的影响;溶液中离子浓度大小比较以及电化学原理的有关判断和应用等

 (6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm,密度为____________(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为___________________pm(列式表示)。
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm,密度为____________(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为___________________pm(列式表示)。