题目内容
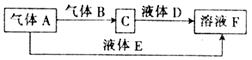
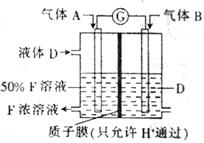
(15分)已知M为氮元素与一种金属元素组成的离子化合物,其中金属元素的质量分数为354%,M在汽车安全气囊中有重要的作用。常温下G为淡黄色固体。H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X均为空气中成分。I、J为常见的工业原料。
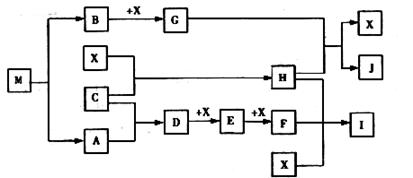
 ①写出D与X反应的化学方程式
①写出D与X反应的化学方程式
 ②写出G与H反应的离子方程式。
②写出G与H反应的离子方程式。
③实验室中I应如何保存?。
④常温下M受撞击时可分解,13gM完全分解为A和B时,放出akJ的热量,写出M分解的热化学方程式。
⑤M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因。

 ①写出D与X反应的化学方程式
①写出D与X反应的化学方程式 ②写出G与H反应的离子方程式。
②写出G与H反应的离子方程式。③实验室中I应如何保存?。
④常温下M受撞击时可分解,13gM完全分解为A和B时,放出akJ的热量,写出M分解的热化学方程式。
⑤M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因。
①4NH3+5O2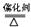 4NO+6H20②2Na2O2+2H2O===4Na++4OH—+O2↑
4NO+6H20②2Na2O2+2H2O===4Na++4OH—+O2↑
③棕色试剂瓶、低温冷暗处④2NaN3(s)===2Na(s)+3N2(g);ΔH=―10akJ/mol
⑤N3―+H2O HN3+OH―
HN3+OH―
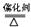 4NO+6H20②2Na2O2+2H2O===4Na++4OH—+O2↑
4NO+6H20②2Na2O2+2H2O===4Na++4OH—+O2↑③棕色试剂瓶、低温冷暗处④2NaN3(s)===2Na(s)+3N2(g);ΔH=―10akJ/mol
⑤N3―+H2O
 HN3+OH―
HN3+OH―略

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目