题目内容
下列叙述正确的是( )
| A、水呈液态、氯化氢在同族元素的氢化物中熔沸点最低可用同一原理解释 |
| B、工业上通常用电解Na、Fe、Cu对应的氯化物制得该三种金属单质 |
| C、S、Cl都有较强的非金属性,S,Cl2都可以将Fe氧化为+3价 |
| D、Al(OH)3、Cu(OH)2均不能在氨水中溶解 |
考点:金属冶炼的一般原理,氢键的存在对物质性质的影响
专题:化学键与晶体结构,金属概论与碱元素
分析:A.氢键较一般的分子间作用力强,含有氢键的物质具有较高的熔沸点,水、HF中含氢键,沸点较高;
B.根据金属的活泼性采用相应的冶炼方法;
C.Cl都有较强的非金属性,可以将Fe氧化为+3价,S的非金属性较弱,可以将Fe氧化为+2价;
D.Al(OH)3不能在氨水中溶解,Cu(OH)2能在氨水中溶解;
B.根据金属的活泼性采用相应的冶炼方法;
C.Cl都有较强的非金属性,可以将Fe氧化为+3价,S的非金属性较弱,可以将Fe氧化为+2价;
D.Al(OH)3不能在氨水中溶解,Cu(OH)2能在氨水中溶解;
解答:
解:A.在氧族元素中氢化物中,由于水有氢键的存在,常温常压下水为液体,H2S为气体,在卤族元素氢化物中,氯化氢在同族元素的氢化物中熔沸点最低,原因是HF含氢键,可用同一原理解释,故A正确;
B.冶炼活泼金属Na,一般用电解熔融的氯化物制得,冶炼较不活泼的金属Fe、Cu,常用还原剂有(C、CO、H2等),故B错误;
C.Cl都有较强的非金属性,Cl2与Fe反应生成FeCl3,S的非金属性较弱,S与Fe共热生成FeS,故C错误;
D.Al(OH)3不能在氨水中溶解,氢氧化铜沉淀溶于氨水生成[Cu(NH3)4]2+,反应的离子方程式为Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,故D错误;
故选A.
B.冶炼活泼金属Na,一般用电解熔融的氯化物制得,冶炼较不活泼的金属Fe、Cu,常用还原剂有(C、CO、H2等),故B错误;
C.Cl都有较强的非金属性,Cl2与Fe反应生成FeCl3,S的非金属性较弱,S与Fe共热生成FeS,故C错误;
D.Al(OH)3不能在氨水中溶解,氢氧化铜沉淀溶于氨水生成[Cu(NH3)4]2+,反应的离子方程式为Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,故D错误;
故选A.
点评:本题主要考查了元素化合物知识,掌握氢键、金属的冶炼方法、S、Cl、Al(OH)3、Cu(OH)2的性质是解答关键,题目难度中等.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目
下列各组物质的性质比较,正确的是( )
| A、碱性:KOH>Ca(OH)2>NaOH |
| B、氢化物稳定性:NH3>H2O>HF |
| C、酸性:HClO>H2SO4>H3PO4 |
| D、氧化性:F2<Cl2<Br2<I2 |
在物质分类中常存在包含关系如图B包含A,下列关系中前者包含后者.其中错误的是( )
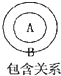

| A、有机物烃 | B、烃脂肪烃 |
| C、脂肪烃烯烃 | D、烯烃氯乙烯 |
下列各组物质充分反应后的产物中,滴入KSCN溶液显红色的是( )
| A、FeO和稀盐酸 |
| B、过量铁粉跟稀硫酸 |
| C、氯水跟FeCl2溶液 |
| D、过量铁粉跟硫酸铁溶液 |
X、Y、Z是短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期.X原子的最外层电子数是其电子层数的3倍.Z原子的核外电子数比Y原子少1.下列说法正确的是( )
| A、元素非金属性由弱到强的顺序为Y<Z<X |
| B、原子半径由大到小的顺序为Z>Y>X |
| C、三种元素的气态氢化物中,Z的气态氢化物最稳定 |
| D、Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 |
归纳与推理是化学学习常用的方法.下列推理正确的是( )
| A、因为稀硫酸能与铁反应放出H2,所以稀硝酸与铁反应也一定能放出H2 |
| B、同族元素具有相似性.因为CaCO3、BaCO3是白色沉淀,所以SrCO3也是白色沉淀 |
| C、蔗糖加入浓硫酸后变黑,说明浓硫酸具有吸水性 |
| D、因为SO2可以使酸性KMnO4溶液褪色,所以SO2具有漂白性 |
1mol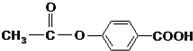 在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )
在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )
 在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )
在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )| A、2mol | B、3mol |
| C、4mol | D、5mol |
有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
A、 2,6-二甲基-5-乙基庚烷 |
B、 3-甲基-1-丁烯 |
C、 2-甲基-3-丁炔 |
D、 1,3,4-三甲苯 |