��Ŀ����
����Ŀ��Ϊ��̽���������{��Ũ���ᷴӦ�IJ��ij�о���ѧϰС���������ͼ��ʾ��ʵ��װ�ã� 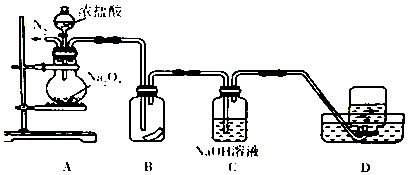
�ش��������⣺
��1��ʵ�鿪ʼǰ��������е�ʵ��������� ��
��2��ʵ�������װ��B��ʪ�����ɫ������ɫ��˵�����ɵ������������ɣ�˵��Na2O2���ԣ�
��3��װ��C����Ҫ������ �� ��Ӧ�����ӷ���ʽΪ ��
��4��Ϊ֤��װ��D���ռ�������ɫ������������Ӧ���е�ʵ������� ��
��5������������Ũ���ᷢ����Ӧ�Ļ�ѧ����ʽ ��
���𰸡�
��1�����װ�������ԣ�����ͨ��һ������N2��װ��D���Ӻ�
��2��Cl2������
��3������HCl������Cl2 �� ��ֹ��Ⱦ������ʹD�����ռ�����Ϊ������������Cl2+2OH���TCl��+ClO��+H2O��H++OH���TH2O
��4����һ�������ǵ�ľ�����뼯��ƿ�У�����ľ����ȼ����֤��������
��5��3Na2O2+6HCl=6NaCl+4H2O+O2��+Cl2��
���������⣺��1��̽���������{��Ũ���ᷴӦ�IJ��������O2��Cl2���ɣ�Ҫʹ��Ӧ˳�����У��豣֤����װ�õ����������ã���ʵ�����������������֤��Ϊ��ֹ��������ʵ�飬���ž�װ���еĿ�����Dװ�ã��ռ�����Ϊ�����������������軺��ͨ��һ������N2��װ��D���Ӻã����Դ��ǣ����װ�������ԣ�����ͨ��һ������N2��װ��D���Ӻã���2��ʪ��ĺ�ɫʯ����ֽ��ɫ��˵����HClO���ɣ�������ˮ��Ӧ����HClO������˵��װ��A����Cl2���ɣ��Ȼ����Щ�1�۵���ֻ�л�ԭ�ԣ�����������Ũ���ᷴӦ�����ɵ�����������������Ԫ�صĻ��ϼ۴ө�1�۱�Ϊ0�ۣ���������˵���������ƾ��������ԣ�
���Դ��ǣ�Cl2����������3��Cl2�ж�����ֱ���ſգ����O2�л���Cl2 �� �ᵼ���ռ���O2����������������лӷ��ԣ��������ɵ������к���HCl��������HCl���ܺ�NaOH��Ӧ����ȥ�����ӷ���ʽΪCl2+2OH���TCl��+ClO��+H2O��H++OH���TH2O����NaOH������������HCl������Cl2 �� ��ֹ��Ⱦ������ʹD�����ռ�����Ϊ������������
���Դ��ǣ�����HCl������Cl2 �� ��ֹ��Ⱦ������ʹD�����ռ�����Ϊ������������Cl2+2OH���TCl��+ClO��+H2O��H++OH���TH2O����4������������ȼ�ԣ�����һ�������ǵ�ľ�����뼯��ƿ�У�����ľ����ȼ����֤����������
���Դ��ǣ���һ�������ǵ�ľ�����뼯��ƿ�У�����ľ����ȼ����֤������������5������������Ũ���ᷢ����Ӧ���Ȼ��ⱻ��������������ӦΪ3Na2O2+6HCl=6NaCl+4H2O+O2��+Cl2����
���Դ��ǣ�3Na2O2+6HCl=6NaCl+4H2O+O2��+Cl2����

 �����ܿ����ϵ�д�
�����ܿ����ϵ�д�

