题目内容
【题目】MgSO4·7H2O是一种重要的化工原料,某研究性学习小组设计了利用菱镁矿石(主要成分是MgCO3,并含有MnCO3、SiO2)制取MgSO4·7H2O的实验流程如下:

已知:Mn2++ClOˉ+H2O=MnO2↓+Clˉ+2H+
(1)过滤1的滤渣主要成分是______。
(2)酸浸时MgCO3发生反应的离子反应方程式为:_________________________。
(3)操作1经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤才可得到产品,检验产品是否洗涤干净的方法是_______________。
【答案】SiO2 MgCO3 +2H+===Mg2+ + CO2↑+H2O 取最后几滴洗涤液于试管中,并滴加稀硝酸酸化的硝酸银溶液,若无白色沉淀生成,则产品已洗涤干净
【解析】
(1)在菱镁矿石中,MgCO3、MnCO3与硫酸都能反应,但SiO2不反应,从而得出过滤1的滤渣主要成分。
(2)酸浸时MgCO3与硫酸反应,生成硫酸镁、水和二氧化碳气体。
(3)操作1经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤才可得到产品,检验产品是否洗涤干净的方法是检验Cl-是否存在。
(1)在菱镁矿石中,MgCO3、MnCO3与硫酸都能反应,但SiO2不反应,从而得出过滤1的滤渣主要成分是SiO2。答案为:SiO2;
(2)酸浸时MgCO3与硫酸反应,生成硫酸镁、水和二氧化碳气体。发生反应的离子反应方程式为MgCO3+2H+==Mg2+ + CO2↑+H2O。答案为:MgCO3+2H+==Mg2+ + CO2↑+H2O;
(3)操作1经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤才可得到产品,检验产品是否洗涤干净的方法是取最后几滴洗涤液于试管中,并滴加稀硝酸酸化的硝酸银溶液,若无白色沉淀生成,则产品已洗涤干净。答案为:取最后几滴洗涤液于试管中,并滴加稀硝酸酸化的硝酸银溶液,若无白色沉淀生成,则产品已洗涤干净。

【题目】实验室制备1,2-二溴乙烷,可用足量的乙醇先制备乙烯,再用乙烯和少量的溴制备1,2-二溴乙烷,装置如下图所示:
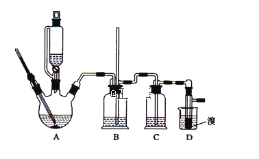
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)写出由乙醇制备乙烯的化学方程式______________________________,乙烯制备1,2-二溴乙烷的化学方程式_______________________________。
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___________;(填正确选项前的字母)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置A中除了浓硫酸和乙醇外,还应加入_____,其目的是_______装置A中生成副产物乙醚的化学反应方程式 ___________________。
(4)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,为了验证二氧化硫的存在并除去二氧化硫对后续反应的干扰,某同学在A和D之间加入了B、C两个装置,其中B和C中可分别盛放 ________________,
a.酸性KMnO4和水 b.品红和NaOH溶液
c.酸性KMnO4和NaOH溶液d.品红和酸性KMnO4
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_____层(填“上”、“下”);若产物中有少量副产物乙醚。可用_______的方法除去。