题目内容
5.实验测得常温下0.1mol/L某一元碱(BOH)溶液的pH值不等于13,0.1mol/L某一元酸(HA)溶液的$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012,将两溶液等体积混和后,所得溶液中不正确的关系有( )| A. | c(A-)>c(B+ )>c(H+)>c(OH-) | B. | c(B+ )+c(H+ )=c(A-)+c(OH-) | ||
| C. | c(B+ )>c(A-)>c(H+ )=c(OH-) | D. | c(BOH)+c(OH-)=c(H+) |
分析 由0.1mol/L某一元碱(BOH)溶液的pH值不等于13,若为强碱其溶液的pH=13,说明BOH为弱碱;0.1mol/L某一元酸(HA)溶液的$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012,即:$\frac{c({H}^{+})}{\frac{{K}_{w}}{c({H}^{+})}}$=1012,解得:c(H+)=0.1mol/L,则HA为强酸,则两溶液等浓度、等体积混合后恰好完全反应生成强酸弱碱盐BA,因B+部分水解,则c(A-)>c(B+),水解使溶液呈酸性,则c(H+)>c(OH-),再由水解的程度很弱,则c(B+)>c(H+),则溶液中离子浓度大小为:c(A-)>c(B+ )>c(H+)>c(OH-);溶液中还存在电荷守恒:c(B+)+c(H+)=c(A-)+c(OH-),物料守恒可得:c(A-)=c(B+)+c(BOH),据此对各选项进行判断.
解答 解:由0.1mol/L某一元碱(BOH)溶液的pH值不等于13,若为强碱其溶液的pH=13,说明BOH为弱碱,
0.1mol/L某一元酸(HA)溶液的$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012,即:$\frac{c({H}^{+})}{\frac{{K}_{w}}{c({H}^{+})}}$=1012,解得:c(H+)=0.1mol/L,则HA为强酸,则两溶液等浓度、等体积混合后恰好完全反应生成强酸弱碱盐BA,
A.因B+部分水解,则c(A-)>c(B+),水解使溶液呈酸性,则c(H+)>c(OH-),再由水解的程度很弱,则c(B+)>c(H+),则溶液中离子浓度大小为:c(A-)>c(B+ )>c(H+)>c(OH-),故A正确;
B.因溶液不显电性,即电荷守恒式为:c(B+)+c(H+)=c(A-)+c(OH-),故B正确;
C.因B+能水解,则c(A-)>c(B+),水解使溶液呈酸性,则c(H+)>c(OH-),故C错误;
D.由溶液的电荷守恒可得:c(B+)+c(H+)=c(A-)+c(OH-),物料守恒可得:c(A-)=c(B+)+c(BOH),两者之和可得:c(H+)=c(BOH)+c(OH-),故D正确;
故选C.
点评 本题考查离子浓度大小比较、酸碱混合的定性判断等知识,题目难度中等,明确酸、碱的强弱是解答本题的关键,然后利用盐类水解的知识即可解答,注意掌握电荷守恒、物料守恒及盐的水解原理的含义及应用方法.

| A. | Na+ | B. | Mg2+ | C. | O2- | D. | F- |
| A. | 可由石油裂解制取 | B. | 通过加聚反应可制得保鲜膜 | ||
| C. | 通过加成反应可制得氯乙烯 | D. | 能使溴水和酸性高锰酸钾溶液褪色 |
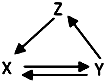 如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )| X | Y | Z | |
| ① | SiO2 | H2SiO3 | Na2SiO3 |
| ② | CH3CH2OH | CH3CHO | CH2=CH2 |
| ③ | AlCl3 | Al(OH)3 | Al2O3 |
| ④ | NO | NO2 | HNO3 |
| ⑤ | FeCl2 | Fe | FeCl3 |
| A. | ③④⑤ | B. | ②③④ | C. | ④⑤ | D. | ①②⑤ |


 ,水杨酸酯E为紫外吸收剂,可用于配制防晒霜.E的一种合成路线如下:
,水杨酸酯E为紫外吸收剂,可用于配制防晒霜.E的一种合成路线如下:
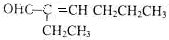 ;若只能一次取样,请提出检验C中2种官能团的简要方案:用银氨溶液先检验醛基,再加稀盐酸使溶液呈酸性后,加溴水检验碳碳双键;
;若只能一次取样,请提出检验C中2种官能团的简要方案:用银氨溶液先检验醛基,再加稀盐酸使溶液呈酸性后,加溴水检验碳碳双键; 、HOCH2CH2C≡C-C≡C-COOH、
、HOCH2CH2C≡C-C≡C-COOH、 ;
; :
: