题目内容
4.下列物质中含离子键的是( )| A. | 石英 | B. | 食盐 | C. | 干冰 | D. | 碘 |
分析 一般来说,活泼金属元素和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,铵根离子和酸根离子之间存在离子键,据此分析解答.
解答 解:A.石英属于原子晶体,原子之间只存在共价键,故A错误;
B.食盐属于离子晶体,阴阳离子之间存在离子键,故B正确;
C.干冰属于分子晶体,二氧化碳分子中C-O原子之间只存在共价键,故C错误;
D.碘属于分子晶体,碘分子中I-I原子之间只存在共价键,故D错误.
故选B.
点评 本题考查离子键、共价键,侧重考查基本概念,明确晶体类型、晶体构成微粒及微粒之间作用力即可解答,注意石英属于原子晶体.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.已知:
(1)C(s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
(2)H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1
(3)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=-870.3kJ•mol-1
根据以上方程式可以计算出2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
(1)C(s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
(2)H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1
(3)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=-870.3kJ•mol-1
根据以上方程式可以计算出2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
| A. | +244.1 kJ•mol-1 | B. | -488.3 kJ•mol-1 | C. | -996.6 kJ•mol-1 | D. | +996.6 kJ•mol-1 |
15.下列热化学方程式中△H代表燃烧热的是( )
| A. | C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H1 | B. | S(s)+3/2O2(g)=SO3(s)△H2 | ||
| C. | CH4(g)+2O2(g)=2H2O(l)+CO(g)△H3 | D. | 2CO(g)+O2(g)=CO2(g)△H4 |
12.下列各项不属于官能团的是( )
| A. | NO3- | B. | -Cl | C. | -CHO | D. | -NO2 |
19.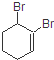 的系统命名的名称是( )
的系统命名的名称是( )
 的系统命名的名称是( )
的系统命名的名称是( )| A. | 1,2-二溴-2-环己烯 | B. | 1,2-二溴-1-环己烯 | ||
| C. | 1,6-二溴-1-环己烯 | D. | 2,3-二溴-1-环己烯 |
9.运用元素周期律分析下面的推断,其中不正确的是( )
| A. | 酸性:H2SiO3>H2CO3>H3PO4 | B. | 稳定性:PH3<H2S<HCl<HF | ||
| C. | 非金属性:Cl>S>P>Si | D. | 离子半径:Cl->F->Na+>Al3+ |
14.25℃时,向10mLpH=12的某碱溶液中加入10mLpH=2的盐酸,充分反应后滴入石蕊试液,溶液显蓝色,则此碱一定是( )
| A. | 弱碱 | B. | 一元强碱 | C. | 多元强碱 | D. | 任何强碱 |
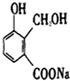
 有一化合物(X)结构简式如图,它与分别与金属钠、氢氧化钠和碳酸氢钠反应时,不可能生成的产物是( )
有一化合物(X)结构简式如图,它与分别与金属钠、氢氧化钠和碳酸氢钠反应时,不可能生成的产物是( )