题目内容
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂。N2H4 (1)与N2O4(g)生成4 mol H2O(g)时放出热量1077 kJ,写出其热反应方程式:_____________________________________。
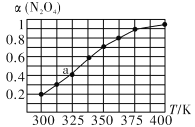
(2)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2 (g)将一定量的 N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
2NO2 (g)将一定量的 N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
①由图推测该反应ΔH_______0(填“>”或“<”),理由为__________________________。
②图中a点对应温度下,已知N2O4的起始压强p0为108 kPa,列式计算该温度下反应的平衡常数Kp =____________。(保留一位小数,并带单位。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
③在一定条件下,该反应N2O4、NO2两者的消耗速率与自身压强间存在关系:v消耗(N2O4)=k1· P(N2O4),v消耗(NO2)=k2·P2(NO2),其中k1、k2是与反应温度有关的速率常数。则一定温度下,k1、k2与平衡常数Kp的关系是k1=________________。
【答案】 2N2H4(l)+N2O4(g)==3N2(g)+4H2O(g) ΔH= -1077 kJ/mol > 升温, N2O4的转化率增大,表明平衡向正反应方向移动,而升温平衡是向吸热反应方向移动的,所以正反应为吸热反应,ΔH>0 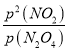 =
=![]() p0(N2O4)=
p0(N2O4)= ![]() ×108kPa=115.2kPa
×108kPa=115.2kPa ![]() k2Kp
k2Kp
【解析】(1)N2H4 (1)与N2O4(g)生成4 mol H2O(g)时放出热量1077 kJ,则热反应方程式为2N2H4(l)+N2O4(g)==3N2(g)+4H2O(g) ΔH= -1077 kJ/mol,故答案为:2N2H4(l)+N2O4(g)==3N2(g)+4H2O(g) ΔH= -1077 kJ/mol;
(2)①根据图知,升高温度转化率增大,升高温度平衡向吸热方向移动,则正反应是吸热反应,故答案为:>;温度升高,α(N2O4)增加,说明平衡右移,该反应为吸热反应,△H>0;
②四氧化二氮的转化率是0.4,设原来四氧化二的物质的量为xmol,转化的物质的量为0.8xmol,则混合气体的物质的量=(x-0.4x+0.8x)mol=1.4xmol,相同条件下,气体的压强之比等于其物质的量之比,所以反应后压强=![]() =151.2kPa,四氧化二氮的分压=151.2kPa×
=151.2kPa,四氧化二氮的分压=151.2kPa×![]() =64.8kPa,二氧化氮的分压=151.2kPa×
=64.8kPa,二氧化氮的分压=151.2kPa×![]() =86.4kPa,化学平衡常数K=
=86.4kPa,化学平衡常数K=![]() =
=![]() =115.2,故答案为:115.2;
=115.2,故答案为:115.2;
③化学平衡常数Kp=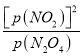 ,二者的反应速率之比等于其计量数之比,所以υ(NO2):υ(N2O4)=k2[p(NO2)]2:k1p(N2O4)=2:1,化学平衡常数Kp=
,二者的反应速率之比等于其计量数之比,所以υ(NO2):υ(N2O4)=k2[p(NO2)]2:k1p(N2O4)=2:1,化学平衡常数Kp=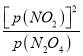 ,则k1=
,则k1=![]() k2·Kp,故答案为:
k2·Kp,故答案为: ![]() k2·Kp。
k2·Kp。