��Ŀ����
����Ŀ��������þ����������ȼ����������������������ʯ(��Ҫ�ɷ�Ϊ![]() ����������
����������![]() ��
��![]() ������)���Ʊ�������������ͼ��ʾ��
������)���Ʊ�������������ͼ��ʾ��

�ش���������
(1)![]() �����������ʽ�ɱ�ʾΪ_________________��
�����������ʽ�ɱ�ʾΪ_________________��
(2)��������ʱ���ʵ����ȵ�Ŀ����_____________________��
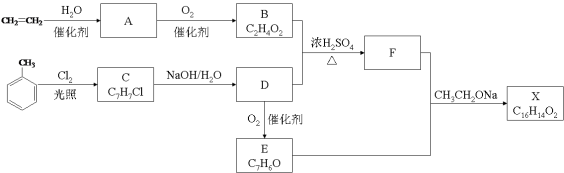
(3)����1����Ҫ�ɷ�Ϊ________(�ѧʽ)����Һ2������������������Ҫ��________��
(4)��Ӧ���м���������������������2�����ӷ���ʽ��___________��
(5)����������Ӧ�л�ԭ����Ϊ![]() �����������������з�����������ԭ��Ӧ�����ӷ���ʽΪ______��
�����������������з�����������ԭ��Ӧ�����ӷ���ʽΪ______��
(6)![]() ����Ϊ��ȼ���ϵ�ԭ��Ϊ_________(������㼴��)��
����Ϊ��ȼ���ϵ�ԭ��Ϊ_________(������㼴��)��
(7)��֪��![]() ������Һ2��
������Һ2��![]() ��ͨ���������˵����
��ͨ���������˵����![]() ʱ�Ƿ���
ʱ�Ƿ���![]() ��������__________��
��������__________��
���𰸡�![]() �ӿ��������ʣ�ʹ���ܸ����
�ӿ��������ʣ�ʹ���ܸ���� ![]() ��
��![]() ��
��![]()
![]() ��
��![]()
![]()
![]()
![]() �ֽ������������ֽ������������ܸ���������
�ֽ������������ֽ������������ܸ���������![]() ���ֽ������ܸ���������ˮ��ˮ������������ ��
���ֽ������ܸ���������ˮ��ˮ������������ ��![]() ����Һ��
����Һ��![]() ��
��![]()
![]() ���ʲ�������
���ʲ�������![]() ����
����
��������
�������̣�����ʯ[��Ҫ�ɷ�ΪMg6Si4O10(OH)8����������NiO��Fe3O4������]��������������ܣ�����1����Ҫ�ɷ�Ϊ���ܵ�SiO2����Һ1����Mg2+��Ni2+��Fe3+���������������۽�Ni2+�û���ͬʱ�������ӻ�ԭΪ�������ӣ�����2ΪNi����Һ2����Mg2+��Fe2+������pH=5������KMnO4��Fe2+����ΪFe(OH)3����������ԭΪMnO2����ӦΪ��MnO4-+3Fe2++7H2O=MnO2��+3Fe(OH)3��+5H+������3ΪFe(OH)3������Һ3�м���ʯ����õ��ͻ����Mg(OH)2������ֽ������������ֽ������������ܸ���������MgO���ܸ���������ˮ��ˮ���������������ݴ˷�������
(1)Mg6Si4O10(OH)8�����������ʽ�ɱ�ʾΪ��6MgO4SiO24H2O��
(2)��������ʱ���ʵ����ȿ��Լӿ��������ʣ�ʹ���ܸ���֣�
(3)���ݷ���������1����Ҫ�ɷ�ΪSiO2(��H2SiO3��H4SiO4)����Һ2������������������Ҫ��Mg2+��Fe2+��
(4)���ݷ�������Ӧ��Ϊ�������������۽�Ni2+�û���ͬʱ�������ӻ�ԭΪ�������ӣ������������������������2�����ӷ���ʽ��Fe+ Ni2+= Ni+ Fe2+��
(5)�������������У�����pH=5������KMnO4��Fe2+����ΪFe(OH)3����������ԭΪMnO2�����ӷ�ӦΪ��MnO4-+3Fe2++7H2O=MnO2��+3Fe(OH)3��+5H+��
(6) Mg(OH)2�ֽ������������ֽ������������ܸ���������MgO���ܸ���������ˮ��ˮ�������������ȣ���Mg(OH)2����Ϊ��ȼ���ϣ�
(7)����pH=5ʱ����Һ�е�c(OH)=1��109mol/L��Qc(Mg2+)c2(OH)=2.0��(1��109)2=2.0��1018��Ksp[Mg(OH)2]=1.8��1011���ʲ�������Mg(OH)2������

 ���ѵ����Ԫ��ĩ���100��ϵ�д�
���ѵ����Ԫ��ĩ���100��ϵ�д� ��˼άС�ھ�100����ҵ��ϵ�д�
��˼άС�ھ�100����ҵ��ϵ�д� ��ʦָ��һ��ͨϵ�д�
��ʦָ��һ��ͨϵ�д�