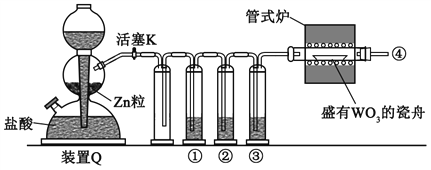
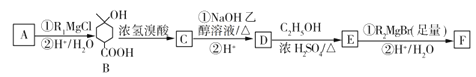
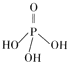
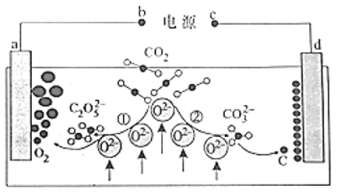
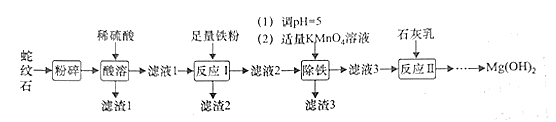
��Ŀ����
����Ŀ������������أ�K2FeO4����һ�����͡���Ч�������ɫˮ����������Cl2��O2��ClO2��KMnO4�����Ը�ǿ��������Ⱦ����ҵ�������Ƶø������ƣ�Ȼ���ڵ����£������������Һ�м���KOH�����ͣ�ʹ�������������
��1���ɷ��Ʊ��������Ƶ���Ҫ��ӦΪ��2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2�����÷�Ӧ����������________���ѧʽ�����������ƣ�Na2O2������Ԫ�ػ��ϼ�Ϊ_____���������֣�
��2��ʪ���Ʊ�������أ�K2FeO4���ķ�Ӧ��ϵ��������������Fe��OH��3��ClO����OH����FeO42-��Cl����H2O��
�����������£��������ͻ�ԭ�������ʵ����ı�Ϊ3:2������Ӧ��д������ƽʪ���Ƹ�����ص����ӷ�Ӧ����ʽ��_________________��
��ÿ����1mol FeO42-ת��___mol���ӣ�����Ӧ������ת����0.3mol���ӣ���ԭ��������ʵ���Ϊ_____mol��
��3����ƽ���滯ѧ����ʽ���ش��������⣺____C +K2Cr2O7+H2SO4=K2SO4+CO2��+Cr2(SO4)3+H2O��
��H2SO4��������Ӧ�б��ֳ����������ǣ���ѡ���ţ�______��
A�������� B�������Ժ����� C������ D����ԭ�Ժ�����
������Ӧ�е���ת����0��8 mol��������������ڱ�״���µ����Ϊ_____L��
���𰸡�Na2O2 -1 4OH- + 2Fe(OH)3 + 3ClO- = 2FeO42- +3Cl- +5H2O 3 0.15 3 2 8 2 3 2 8 C 4.48
��������
��1��FeԪ�ػ��ϼ����ߣ�Na2O2��OԪ�صĻ��ϼ����ߡ�Ҳ���ͣ�
��2�����������£��������ͻ�ԭ�������ʵ����ı�Ϊ3��2������Ӧ����Fe (OH)3��ClO-�����ʵ�����Ϊ2��3�����ӷ�Ӧ��ѭ���ӡ���ɼ�ԭ���غ㣻��3����Ӧ��C��0�����ߵ�������̼�е�+4�ۣ�K2Cr2O7�е�Cr��+6�۽�ΪCr2(SO4)3�е�+3�ۣ�����������ԭ��Ӧ��ʧ�����غ���ɽ��ԭ�Ӹ����غ������ƽ����ʽ�������������ڷ�Ӧ��Ԫ�ػ��ϼ۱仯����ж�������ֵ����ʣ������ݷ���ʽ3C+2K2Cr2O7+8H2SO4=2K2SO4+3CO2��+2Cr2(SO4)3+8H2O��ÿ����3mol������̼��ת�Ƶ�����Ϊ3mol����4-0��=12mol���������ɶ�����̼�����ʵ���������V=nVm�������������
��1��FeԪ�ػ��ϼ����ߣ�Na2O2��OԪ�صĻ��ϼ����ߡ�Ҳ���ͣ���÷�Ӧ��Na2O2 ����������Na2O2����Ԫ��Ϊ-1�ۣ��ʴ�Ϊ��Na2O2��-1��
��2���ټ��������£��������ͻ�ԭ�������ʵ����ı�Ϊ3��2������Ӧ����Fe��OH��3��ClO-�����ʵ�����Ϊ2��3�����ӷ�ӦΪ2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O���ʴ�Ϊ��2Fe(OH03+3ClO-+4OH-=2FeO42-+3Cl-+5H2O��
�ڷ�Ӧ��FeԪ�ػ��ϼ۱仯��+3������Ϊ+6����ÿ����1mol FeO42-ת�Ƶ���1mol����6-3��=3mol�����ڻ�ԭ����ΪCl-������Ӧ������ת����0.3mol���ӣ���ԭ��������ʵ���Ϊ![]() =0.15mol���ʴ�Ϊ��3�� 0.15��
=0.15mol���ʴ�Ϊ��3�� 0.15��
��3����Ӧ��C��0�����ߵ�������̼�е�+4�ۣ�K2Cr2O7�е�Cr��+6�۽�ΪCr2(SO4)3�е�+3�ۣ�Ҫʹ�������õ����������ڻ�ԭ��ʧȥ����������Cϵ��Ϊ3��K2Cr2O7ϵ��Ϊ2������ԭ�Ӹ����غ㣬��Ӧ�ķ���ʽ��3C+2K2Cr2O7+8H2SO4=2K2SO4+3CO2��+2Cr2(SO4)3+8H2O���ʴ�Ϊ��3��2��8��2��3��2��8��
�����ڷ�Ӧ��Ԫ�ػ��ϼ۲��䣬����ֻ�������ԣ���ѡ��C��
�����ݷ���ʽ3C+2K2Cr2O7+8H2SO4=2K2SO4+3CO2��+2Cr2(SO4)3+8H2O��ÿ����3mol������̼��ת�Ƶ�����Ϊ3mol����4-0��=12mol����������Ӧ�е���ת����0.8mol�����������������ʵ���Ϊ0.2mol����������Ϊ0.2mol��22.4L/mol=4.48L���ʴ�Ϊ��4.48��