题目内容
某同学对一瓶Na2SO3固体样品进行如下实验:取出少量,加水完全溶解,滴入Ba(NO3)2
溶液,产生白色沉淀,再加入足量稀硝酸,仍有白色沉淀剩余。下述叙述正确的是
| A.无法确定样品中钠、硫元素的质量比 |
| B.Na2SO3已被氧化 |
| C.加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 |
| D.加入稀硝酸后的沉淀一定是BaSO4 |
D
解析试题分析:A.Na2SO3若不变质,n(Na):n(S)=2:1;若变质,得到的为Na2SO4.n(Na):n(S)=2:1。因此样品中钠、硫元素的质量比为46:32=23:16.错误。B.若未变质,发生反应:Na2SO3+ Ba(NO3)2= BaSO3↓+2NaNO3.再加入足量稀硝酸时,发生反应3BaSO3+ 2HNO3= 3BaSO4↓+2NO↑+ H2O.;若变质为Na2SO4+ Ba(NO3)2= BaSO4↓+2NaNO3.都会产生白色沉淀BaSO4。因此不能确定Na2SO3是否已被氧化,错误。C.根据B的分析可知若未变质,加入Ba(NO3)2溶液后,生成的沉淀中不含有BaSO4。错误。D.无论是否变质,加入稀硝酸后最终得到的沉淀一定是BaSO4。正确。
考点:考查关于Na2SO3是否已被氧化变质的现象及操作的知识。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
化学与日常生活密切相关,下列说法错误的是
| A.碘酒是指单质碘的乙醇溶液 |
| B.84消毒液的有效成分是NaClO |
| C.浓硫酸可刻蚀石英制艺术品 |
| D.装饰材料释放的甲醛会造成污染 |
下列说法正确的是
| A.二氧化硫具有较强的还原性,故不能用浓硫酸干燥 |
| B.含极性键的共价化合物一定是电解质 |
| C.氯化钠、冰醋酸、酒精分别属于强电解质、弱电解质、非电解质 |
| D.天然气、酒精和液化石油气分别属于化石能源、不可再生能源和二次能源 |
一定量的浓硝酸与过量的铜充分反应,生成的气体是
| A.只有NO2 | B.只有NO | C.NO2和NO | D.NO2和H2 |
下列属于物理变化的是
| A.氯气溶于水 | B.食物变质 | C.用四氯化碳萃取碘水中的碘 | D.光合作用 |
某浓H2SO4的标签上写明含H2SO4 96~98.3%,欲得其准确的值,有效的方法是
| A.测pH值 | B.测导电性大小 | C.测密度 | D.进行中和滴定 |
下列气体:①NH3 ②NO2 ③NO ④O2 ⑤SO2中,适于用下图装置制取和收集的气体是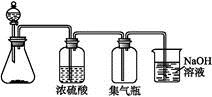
| A.①② | B.②③ | C.③④ | D.②⑤ |
美国宇航局“凤凰”号火星登陆器的显微、电子化学及传导分析仪对两份土壤样本的分析发现,火星北极区表层土壤可能含有高氯酸盐,可创造不利于任何潜在生命的恶劣环境。则下列说法错误的是( )。
| A.含有高氯酸盐的土壤不利于生命存在与高氯酸盐具有较强的氧化性有关 |
| B.当元素处于最高价态时一定具有强氧化性 |
| C.可以考虑用加入亚铁盐等还原性物质的方法改善这种土壤 |
| D.一定条件下高氯酸盐能与浓盐酸反应生成氯气 |