题目内容
同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)  2NH3(g) △H=" -92.6kJ/mol." 测得数据如下表
2NH3(g) △H=" -92.6kJ/mol." 测得数据如下表
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
| N2 | H2 | NH3 | ||
| (1) | 2 | 3 | 0 | 27.78kJ |
| (2) | 1.6 | 1.8 | 0.8 | Q |
下列叙述不正确的是
A.容器(1)(2)反应达平衡时压强相等
B.容器(2)中反应开始时v(正)>v(逆)
C.容器(2)中反应达平衡时,吸收的热量Q为9.26kJ
D.若条件为“绝热恒容”,容器(1)中反应达平衡时n(NH3)<0.6mol
B
解析试题分析:因为容器(2)可以理解为容器(1)反应一段时间,生成了0.8molNH3,故可以认为两个反应是等效的,A正确;因为容器(1)放出27.78kJ的热,说明达到平衡时N2反应了0.3mol,即平衡时是1.7molN2,故反应(2)向逆向反应,故B不正确;反应(2)必须向逆向反应生成0.1molN2,故吸收9.26kJ的热,C正确;在恒温条件下,生成0.6molNH3,若条件为“绝热恒容”,相当反应进行升温,正反应反应是放热反应,平衡向逆向移动,达到平衡时n(NH3)<0.6mol,D正确。
考点:化学反应热的计算、等效平衡与平衡移动。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案对于可逆反应mA(g)十nB(g) pC(g)十qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象。下列判断正确的是
pC(g)十qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象。下列判断正确的是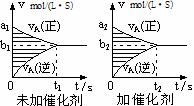
| A.b1>b2,t1>t2 |
| B.两图中阴影部分面积一定相等 |
| C.A的平衡转化率(II)大于(Ⅰ)中A的转化率 |
| D.若m+n<p+q,则压强变化对正反应速率的影响程度比逆反应速率影响程度大 |
在一个不导热的密闭反应器中,只发生两个反应:
a(g)+b(g) 2c(g) ΔH1<0
2c(g) ΔH1<0
x(g)+3y(g) 2z(g) ΔH2>0
2z(g) ΔH2>0
进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是( )
| A.等压时,通入惰性气体,c的物质的量不变 |
| B.等压时,通入z气体,反应器中温度升高 |
| C.等容时,通入惰性气体,各反应速率不变 |
| D.等容时,通入z气体,y的物质的量浓度增大 |
2SO2(g)+O2(g)  2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
| | 甲 | 乙 | 丙 | 丁 | |
| 起始物质的量 | n(SO2)/mol | 0.40 | 0. 40 | 0.80 | 0 |
| n(O2)/mol | 0.24 | 0.48 | 0.48 | 0.04 | |
| n(SO3)/mol | 0 | 0 | 0 | 0.40 | |
| 含硫反应物的平衡转化率/% | 80 | α1 | α2 | α3 | |
下列判断中,正确的是( )
A.丁中SO3的平衡转化率为α3=80%
B.该温度下,平衡常数的值为400
C.平衡时,丙中c(SO3)是甲中的2倍
D.平衡时,甲中O2的转化率小于乙中O2的转化率
一定温度下,对于反应N2+O2 2NO在密闭容器中进行,下列措施能增大反应速率的是 ( )。
2NO在密闭容器中进行,下列措施能增大反应速率的是 ( )。
| A.缩小体积使压强增大 | B.恒容,充入N2 |
| C.恒容充入氦气 | D.恒压充入氦气 |
已知可逆反应:X(s)+aY(g) bZ(g);ΔH,反应达到平衡时,温度、压强对可逆反应的影响如右图所示(图中p为压强,其中p1>p2)。下列有关判断正确的是( )
bZ(g);ΔH,反应达到平衡时,温度、压强对可逆反应的影响如右图所示(图中p为压强,其中p1>p2)。下列有关判断正确的是( )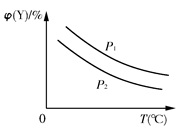
| A.可逆反应的焓变ΔH<0 |
| B.反应的化学计量数a<b |
C.该可逆反应的平衡常数K=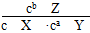 |
| D.温度、压强不变,若使用合适的催化剂,可以提高Y的转化率 |

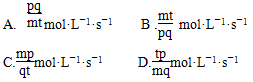
 cC(g),1 min时达到平衡,C的浓度为x mol·L-1。若保持温度不变,将密闭容器的容积压缩为原来的
cC(g),1 min时达到平衡,C的浓度为x mol·L-1。若保持温度不变,将密闭容器的容积压缩为原来的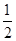 ,重新达到平衡后,C的浓度为2.5 x mol·L-1,下列说法正确的是 ( )
,重新达到平衡后,C的浓度为2.5 x mol·L-1,下列说法正确的是 ( ) mol·(L·min)-1
mol·(L·min)-1