题目内容
【题目】在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=___________,已知:K(300 ℃)>K(350 ℃),该反应的逆反应是_______反应(填“放热”或“吸热”)。
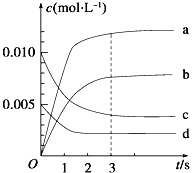
(2)图中表示NO2的变化的曲线是____________,用O2的浓度变化表示从0~2 s内该反应的平均速率v=_____________。
(3)能说明该反应已经达到平衡状态的是________。
a v(NO2)=2v(O2) b 容器内压强保持不变
c v逆(NO)=2v正(O2) d 容器内物质的密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a 及时分离出NO2气体 b 适当升高温度
c 选择高效的催化剂 d 增大O2的浓度
【答案】![]() 吸热 b 1.5×10-3 mol·L-1·s-1 bc d
吸热 b 1.5×10-3 mol·L-1·s-1 bc d
【解析】
(1)2NO(g)+O2(g) ![]() 2NO2(g)的平衡常数表达式K=
2NO2(g)的平衡常数表达式K=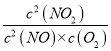 ;温度越高,平衡常数越小,说明升高温度平衡逆向移动,正反应为放热反应,逆反应为吸热反应,故答案为:
;温度越高,平衡常数越小,说明升高温度平衡逆向移动,正反应为放热反应,逆反应为吸热反应,故答案为: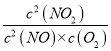 ;吸热;
;吸热;
(2)NO2是产物,随反应进行浓度增大,平衡时△c(NO2)=△c(NO)=![]() =0.0065mol/L,所以图中表示NO2变化的曲线是b;2s内用NO表示的平均反应速率v(NO)=
=0.0065mol/L,所以图中表示NO2变化的曲线是b;2s内用NO表示的平均反应速率v(NO)=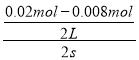 =3.0×10-3molL-1s-1,速率之比等于化学计量数之比,所以v(O2)=
=3.0×10-3molL-1s-1,速率之比等于化学计量数之比,所以v(O2)=![]() v(NO)=
v(NO)=![]() ×3.0×10-3molL-1s-1=1.5×10-3molL-1s-1,故答案为:b;1.5×10-3molL-1s-1;
×3.0×10-3molL-1s-1=1.5×10-3molL-1s-1,故答案为:b;1.5×10-3molL-1s-1;
(3)a.表示同一方向反应速率,v(NO2)自始至终为v(O2)的2倍,不能说明达到平衡,若分别为正、逆速率,等于化学计量数之比,反应到达平衡,故a错误;b.随反应进行,反应混合气体总的物质的量在减小,压强减小,压强保持不变,说明反应到达平衡,故b正确;c.不同物质表示速率,到达平衡时,正逆速率之比等于化学计量数之比,v逆(NO):v正(O2)=2:1,即v逆(NO)=2v正(O2),故c正确;d.混合气体的总质量不变,容器容积为定值,所以密度自始至终不变,不能说明达到平衡,故d错误;故选:bc;
(4)a.及时分离出NO2气体,平衡正向移动,但生成物浓度降低,反应速率减小,故a错误;b.适当升高温度,反应速率加快,但平衡逆向移动,故b错误c.使用高效催化剂可以加快反应速率,但不影响平衡移动,故c错误,d.增大反应物O2的浓度,反应速率增大,平衡正向移动,故d正确;故选d。

 快捷英语周周练系列答案
快捷英语周周练系列答案【题目】已知下列元素的原子半径:
元素 | N | S | O | Si |
原子半径/1010 m | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,磷元素的原子半径可能是
A. 0.80×1010 m B. 1.10×1010 m
C. 1.20×1010 m D. 0.70×1010 m
【题目】根据下列实验方案所得到的现象,得出的结论一定正确的是
甲中玻璃管盛放的物质 | 乙中现象 | 结论 | |
A | 还原铁粉、用水湿润的玻璃纤维 | 肥皂水中有气泡 | 水蒸气高温下与铁反应生成了氢气 |
B | CaCO3 、SiO2 | 石灰水变浑浊 | CaCO3 和 SiO2 高温下反应生成了 CO2 |
C | 碎瓷片、石蜡油(主要成分为烷烃) | 酸性 KMnO4 溶液褪色 | 石蜡油可能发生了分解反应 |
D | FeCl3 固体(熔点 306℃、沸点 315℃)、MnO2 固体 | 淀粉 KI 溶液变蓝 | 加热时 MnO2 能将 FeCl3 氧化成 Cl2 |
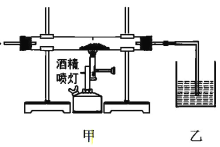
A. A B. B C. C D. D