题目内容
【题目】SO2及Cl2是实验室常见的两种气体。
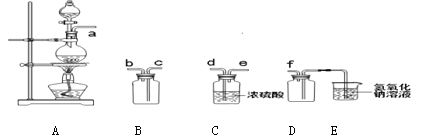
(1)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2 ,按气流方向连接各仪器接口,顺序为a![]()
![]()
![]()
![]()
![]() f,装置D的作用是_____。
f,装置D的作用是_____。
(2)实验室制取纯净的氯气,除了二氧化锰、浓盐酸和浓硫酸,还需要________、________(填写试剂或溶液名称)。
(3)将Cl2通入水中,所得溶液中具有氧化性的含氯粒子有 (填微粒符号)。
(4)某小组利用刚吸收过少量SO2的NaOH溶液对Cl2进行尾气处理。
①请完成吸收初期的化学方程式:Cl2+Na2SO3+2 NaOH= 。
②吸收一段时间后,某同学取出2mL吸收后的溶液(强碱性)于试管中,充分振荡后向其中滴加3~4滴淀粉-KI溶液,发现溶液先变蓝,随即又褪去。溶液先变蓝,说明吸收后的溶液中存在 (填微粒符号),用离子方程式表示蓝色褪去的可能原因: 。
【答案】(1)d、e、c、b 防倒吸
(2)饱和食盐水、NaOH溶液
(3)Cl2、HClO、 ClO-
(4)2NaCl+Na2SO4+ H2O
(5)ClO- I2 +2OH-=I- + IO- +2H2O
【解析】
试题分析:(1)A是SO2的制备装置,B是收集装置,C是干燥装置,由于SO2密度大于空气,应该用向上排空气法收集,则连接顺序为a、d、e、c、b、f。又因为SO2有毒,需要尾气处理,且易溶于水,所以D装置的作用是防止倒吸。
(2)实验室制取纯净的氯气,除了二氧化锰、浓盐酸和浓硫酸,还需要除去氯化氢的饱和食盐水以及尾气处理的氢氧化钠。
(3)将Cl2通入水中,部分氯气与水反应生成氯化氢和次氯酸,次氯酸电离出氢离子和次氯酸根离子,则所得溶液中具有氧化性的含氯粒子有Cl2、HClO、ClO-。
(4)①氯气具有强氧化性,能把亚硫酸钠氧化为硫酸钠,反应的化学方程式为Cl2+Na2SO3+2 NaOH=2NaCl+Na2SO4+H2O。
②溶液先变蓝,说明有氧化性的微粒把碘化钾氧化为单质碘,则吸收后的溶液中存在ClO-;蓝色褪去是由于生成的碘与氢氧根反应,方程式为I2 +2OH-=I- + IO- +2H2O。