题目内容
在100mL混合溶液中,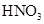 和
和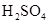 物质的量浓度分别为
物质的量浓度分别为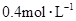 和
和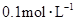 ,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中
,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中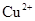 物质的量浓度(
物质的量浓度(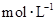 )为
)为
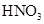 和
和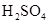 物质的量浓度分别为
物质的量浓度分别为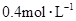 和
和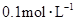 ,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中
,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中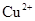 物质的量浓度(
物质的量浓度(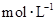 )为
)为| A.0.15 | B.0.225 | C.0.35 | D.0.45 |
B
试题分析:溶液中的氢离子既包括硝酸电离的又包括硫酸电离的.所以氢离子的物质的量为:n=0.4mol?L-1×0.1L+0.1mol?L-1×0.1L×2=0.06mol,硝酸根的物质的量n=0.4mol?L-1×0.1L=0.04mol,
硝酸和铜反应的离子方程式如下:
3Cu+8H++2NO3-=3Cu2++2NO↑+3H2O
8 2
0.06mol(不足)0.04mol
由方程式知,氢离子与硝酸根离子的物质的量为4:1时恰好完全反应,但实际上,氢离子与硝酸根离子是物质的量之比为3:2,所以氢离子的物质的量不足,反应时应以氢离子的物质的量为标准计算,所以有 0.06mol氢离子反应时,生成的铜离子为0.0225mol ,物质的量浓度为0.225
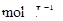 。
。点评:本题看起来稀硫酸不参加反应,但是硝酸铜电离出的硝酸根离子和稀硫酸电离出的氢离子又可看做是硝酸,这是解答本题的关键。

练习册系列答案
相关题目