题目内容
【题目】(1)镉镍可充电电池在现代生活中有广泛应用,已知某镍镉电池的电解质溶液为KOH溶液,它的充、放电反应按下式进行:
Cd + 2NiO(OH) + 2H2O![]() Cd(OH)2 + 2Ni(OH)2
Cd(OH)2 + 2Ni(OH)2
由此可知,该电池放电时的正极反应式为__________________,放电时负极附近溶液的碱性___________(填“增强”、“减弱”或“不变”)。该电池充电时,阳极上发生的是__________反应(填“氧化”或“还原”)。
(2)如图为相互串联的甲、乙两个电解池,试回答下列问题:

①甲池若为用电解原理精炼铜的装置,A极是电解池的____________,材料是_________;电极反应式为______________________。
②若甲池阴极增重19.2 g,则乙池阳极放出气体在标准状况下的体积为__________L(不考虑气体的溶解情况)
【答案】NiO(OH) + e- + H2O = OH- + Ni(OH)2 减弱 氧化 阴极 纯铜 Cu2++2e- = Cu 6.72
【解析】
放电时是原电池工作原理,正极上得电子发生还原反应,即NiO(OH) + e- + H2O = OH- + Ni(OH)2,负极上发生失电子的氧化反应,即Cd-2e - +2OH - =Cd(OH)2,充电时是电解池的工作原理,电解池中,阴极发生得电子的还原反应,2e - +Cd(OH) 2 =Cd+2OH -,阴极附近溶液的pH增大,阳极上失电子发生氧化反应。
(1)放电时是原电池工作原理,正极上得电子发生还原反应,即NiO(OH) + e- + H2O = OH- + Ni(OH)2 。负极上发生失电子的氧化反应,即Cd-2e - +2OH - =Cd(OH)2,故碱性减弱。充电时是电解池的工作原理,阳极上失电子发生氧化反应,故答案为:NiO(OH) + e- + H2O = OH- + Ni(OH)2;减弱;氧化;
(2)①甲池中A电极和电源的负极相连,做阴极,B是阳极,甲池若为用电解原理精炼铜的装置,则B是连接粗铜,做阳极,A连接纯铜,溶液中的铜离子放电,电极反应式是Cu 2 + +2 e - =Cu,故答案为:阴极;纯铜;Cu2++2e- = Cu;
②若甲池为电解精炼铜,阴极增重19.2g,即析出的铜是19.2g,物质的量是0.3mol,转移0.6mol电子。则根据电子的得失守恒可知,乙池中生成氯气的物质的量是0.6mol÷2=0.3mol,在标准状况下的体积是6.72L,故答案为:6.72。

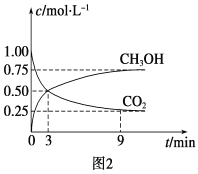
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g) ![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示
容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1.0L |
温度/℃ | T1 | T2 | T2 |
反应物起始量 | 0.5molA 1.5 molB | 0.5 molA 1.5 molB | 2.0 molA 6.0 molB |
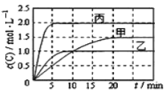
下列说法正确的是
A.由图可知:T1<T2,且该反应为吸热反应
B.T2时该反应的平衡常数K=0.8
C.l0min内甲容器中反应的平均速率v(B)=0.025mol·(L·min)-1
D.T1℃,若起始时甲容器中充入1.5molA、0.5molB,平衡时B的转化率为25%